Z hlediska chemické struktury patří alkany do skupiny uhlovodíků. Tyto sloučeniny obsahují pouze dva typy atomů: uhlík a vodík. Jsou složeny ze základní uhlíkové struktury spojené s atomy vodíku. Alkany mají pouze jednoduché vazby, proto se nazývají nasycené uhlovodíky.

Homologní série
Zástupci alkanů, uspořádaní rostoucím množstvím atomů vodíku ve své struktuře, tvoří homologickou řadu. Začíná to metanem, obsahujícím jeden atom uhlíku, a končí děkanem s devíti atomy uhlíku. Názvy alkanů pocházejí z množství atomů uhlíku, které existují ve struktuře a jsou definovány řeckými nebo latinskými číslicemi a také charakteristickou koncovkou -ane, jako u heptanu, nonanu atd. Obecný vzorec pro alkany je následující: , kde ‘n’ znamená uhlíkové (C) číslo přítomné v řetězci a ‘H’ představuje atomy vodíku.
| Počet atomů uhlíku přítomných v řetězci | Alkanový vzorec | Alkanové jméno |
| 1 | CH 4 | Metan |
| 2 | C2H6 _ | Etan |
| 3 | C3H8 _ | Propan |
| 4 | C4H10 _ | Butan |
| 5 | C5H12 _ | pentan |
| 6 | C6H14 _ | Hexan |
| 7 | C7H16 _ | Heptan |
| 8 | C 8H 18 | Oktan |
| 9 | C9H20 _ | Nonane |
| 10 | C10H22 _ | Dekane |
Druhy nasycených uhlovodíků
Z hlediska struktury řetězce rozlišujeme následující typy alkanů:
-
Lineární (parafinové) alkany
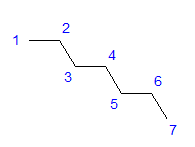 Obr. 1 Strukturní vzorec heptanu Všechny atomy uhlíku vykazují sp3 hybridizaci. Vzhledem k tetragonálnímu úhlu mezi vazbami je vyžadováno klikaté uspořádání atomů uhlíku. Molekuly mohou mít různá uspořádání, protože kolem jednoduché vazby mezi atomy uhlíku je možná volná rotace. Čím vyšší je uhlíkové číslo ve struktuře, tím rozmanitější mohou být tvary řetězců.
Obr. 1 Strukturní vzorec heptanu Všechny atomy uhlíku vykazují sp3 hybridizaci. Vzhledem k tetragonálnímu úhlu mezi vazbami je vyžadováno klikaté uspořádání atomů uhlíku. Molekuly mohou mít různá uspořádání, protože kolem jednoduché vazby mezi atomy uhlíku je možná volná rotace. Čím vyšší je uhlíkové číslo ve struktuře, tím rozmanitější mohou být tvary řetězců.
-
Isoalkany: rozvětvené nasycené uhlovodíky
Tvorba rozvětvených uhlovodíků je výsledkem spojení mezi atomem uhlíku a více než dvěma dalšími atomy uhlíku. V místě takového spojení se vytvoří větev. Rozvětvené uhlovodíky jsou lineární izomery uhlovodíků. 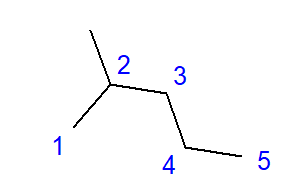 Obr. 2 Strukturní vzorec pro 2-methylpentan Vzorec pro 2-methylpentan uvedený na obr. 2 má celkem šest atomů uhlíku a je izomerem hexanu. Název ‘2-methylpentan’ znamená, že pentanový řetězec má v poloze druhého atomu uhlíku spojenou methylovou skupinu. Počet možných strukturních izomerů roste spolu s rostoucím počtem uhlíku. Abychom uvedli příklad, hexan může mít strukturu 5 různých izomerů, oktan má 18 takových možností a hexan až 75.
Obr. 2 Strukturní vzorec pro 2-methylpentan Vzorec pro 2-methylpentan uvedený na obr. 2 má celkem šest atomů uhlíku a je izomerem hexanu. Název ‘2-methylpentan’ znamená, že pentanový řetězec má v poloze druhého atomu uhlíku spojenou methylovou skupinu. Počet možných strukturních izomerů roste spolu s rostoucím počtem uhlíku. Abychom uvedli příklad, hexan může mít strukturu 5 různých izomerů, oktan má 18 takových možností a hexan až 75.
-
Cyklické uhlovodíky: cykloalkany, alicyklické uhlovodíky
Strukturu řetězce je možné uzavřít při vytváření prstenců složených z opakujících se prvků –CH 2 -. Názvy jsou založeny na názvu alkanu s předponou „cyklo-“, jako je cyklobutan nebo cykloheptan. Pro usnadnění mohou být prezentovány jako pravidelné polygony. 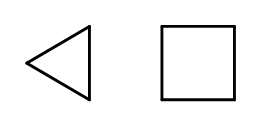 Obr. 3 Zleva: cyklopropan, cyklobutan Existují také substituční kruhy, jejichž názvy obsahují substituenty. V tomto případě jsou počty atomů uhlíku navrženy tak, že umístění substituentů je možná nízké.
Obr. 3 Zleva: cyklopropan, cyklobutan Existují také substituční kruhy, jejichž názvy obsahují substituenty. V tomto případě jsou počty atomů uhlíku navrženy tak, že umístění substituentů je možná nízké.
Nejdůležitější představitelé
Metan je sloučenina s molekulárním vzorcem CH 4 , začínající homologní řadu alkanů. Uhlík je čtyřmocný, má tedy čtyři vazby CH. Při pokojové teplotě je to bezbarvý plyn bez zápachu. Protože atom uhlíku vykazuje sp 3 hybridizaci, je strukturován jako čtyřstěn a vytvořené orbitaly tvoří ekvivalentní vazby spolu se čtyřmi atomy vodíku. Ethan je další alkan v řadě, jehož molekulový vzorec je C 2 H 6 . Při pohledu na semistrukturní vzorec H3C- CH3 si všimneme, že každý atom uhlíku je spojen se třemi atomy vodíku. Stejně jako metan a jiné nižší uhlovodíky je to bezbarvý plyn bez zápachu. CH vazby jsou frontální sigma sp-s vazby, zatímco jednoduchá vazba mezi atomy uhlíku je frontální sigma sp-sp vazba.
Syntéza alkanů
- Hydrogenace alkenů nebo alkynů

- Hydrolýza Grignardových sloučenin
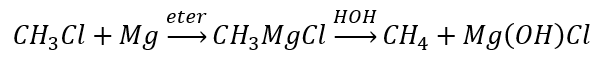
- Redukce alkylhalogenidů
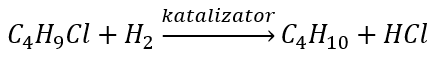
- Wurtzova reakce
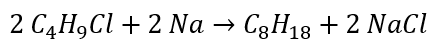
Redukce aldehydů a ketonů
- Clemmensenova redukce
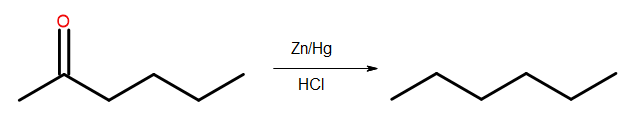 Obr. 4 Schéma Clemmensenovy redukce
Obr. 4 Schéma Clemmensenovy redukce
- Wolff-Kishnerova reakce
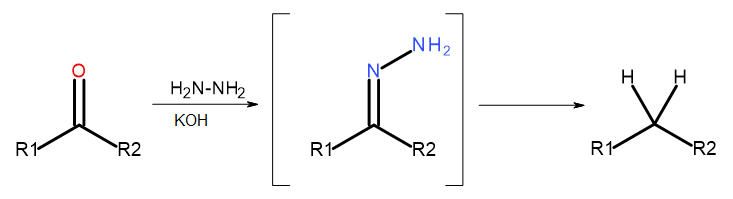 Obr. 5 Schéma Wolff-Kishnera
Obr. 5 Schéma Wolff-Kishnera
Fyzikálně-chemické vlastnosti alkanů
Alkany s krátkým řetězcem od C 1 do C 4 při pokojové teplotě jsou plyny. Další homology (počínaje pentanem) jsou kapaliny s rostoucím bodem varu. Větve přítomné ve struktuře mají za následek nižší teplotu varu izomerů. Závislost přidání další –CH 2 – skupiny do struktury zvyšuje bod varu o 20–30 o C výše spolu s délkou uhlíkového řetězce. Stav agregace alkanů od oktadekanu nahoru je pevný s teplotami tání od 28 ° C pro n-oktadekan. Pevné uhlovodíky zahrnují parafín, zatímco vyšší kapalné uhlovodíky zahrnují parafinový olej. Díky své hydrofobní povaze se molekuly alkanu nemísí s vodou, nejsou vodou smáčeny a nerozpouštějí se ve vodě. Díky své afinitě k nepolárním vlastnostem se však snadno rozpouštějí samy o sobě a v podobných nepolárních, středně a nízkopolárních organických rozpouštědlech. Rozpustnost alkanů ve dvou populárních alkoholových rozpouštědlech (methanol a ethanol) je relativně dobrá. V metanolu se alkany dobře rozpouštějí pouze do stanovené koncentrace. Přebytek této koncentrace způsobí oddělení fází. V etanolu se nižší alkany rozpouštějí velmi snadno, zatímco vyšší alkany je o něco obtížnější. Vyšší uhlovodíky jsou hořlavé látky. Plynné uhlovodíky i páry kapalných uhlovodíků tvoří při smíchání se vzduchem směsi s potenciálem výbuchu. Reaktivita alkanů je relativně nízká kvůli nedostatku potenciálně reaktivních funkčních skupin. Vazby mezi atomy uhlíku (CC) i mezi atomy uhlíku a kyslíku (CH) jsou vysoce odolné vůči štěpení. Energie těchto vazeb jsou 88 kcal/mol, respektive 104 kcal/mol. Mohou náhle reagovat pouze za určitých podmínek.
Reakce alkanů
- Úplné spalování – s emisemi oxidu uhličitého
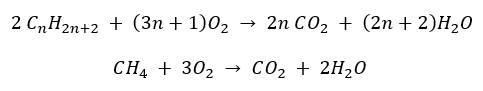
- Polospalování – s omezeným množstvím kyslíku a emisemi oxidu uhelnatého
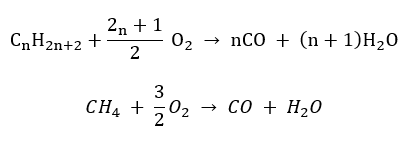
- Nedokonalé spalování – saze vznikají s velmi omezeným množstvím kyslíku
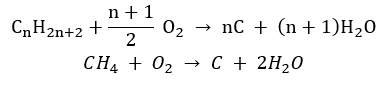
- Substituční reakce (radikálová halogenace, příkladem je reakce methanu s chlorem za účasti světla)
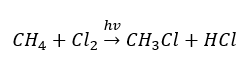
- Pyrolýza je rozklad alkanů na menší molekuly při velmi vysoké teplotě. V závislosti na procesu může dojít ke krakování, hydrokrakování nebo izomerizaci.
- Nitrace s použitím kyseliny dusičné (V) a tvorba směsi produktů: izomerů se substituentem –NO 2 na různých místech.
- Dvoustupňová sulfonace, kde mersoly jsou meziprodukty a mersolany jsou konečným produktem.
























































































































