Chemická aktivita je podle definice schopnost prvku darovat elektrony v chemických reakcích. V praxi se jejich aktivita zvyšuje s klesající elektronegativitou – mírou schopnosti prvku přitahovat elektrony. Pokud kov silně nepřitahuje elektrony, je reaktivnější. Referenční prvek, vodík, se používá ke klasifikaci chemické aktivity kovů. Měřítkem aktivity kovu je jeho schopnost vytěsňovat vodík z kyselin nebo vodík z molekuly vody.

Řady chemické aktivity kovů
Tento termín se používá k popisu souhrnu chemických prvků, které jsou kovové povahy , v určitém pořadí od nejméně po chemicky nejvíce aktivní. To se používá k porovnání aktivity různých kovů. Kromě kovů zahrnuje řada chemických aktivit také jeden nekov, vodík , který je referenčním prvkem. Čím výše v řadě aktivit je kov, tím je reaktivnější . Souvisí to také s tím, že se snadněji oxiduje, a proto je silnější redukční činidlo a chemicky aktivnější prvek. Naopak, čím níže v řadě aktivit je kov umístěn, tím je méně reaktivní. To znamená, že snáze podléhá redukční reakci a je tedy silnějším oxidantem, méně aktivním prvkem. Pomocí hodnot uvedených v tabulce 1 můžeme vidět, že čím nižší je hodnota standardního potenciálu prvku, tím silnější je redukční činidlo a tím je kov chemicky reaktivnější. Měřítkem schopnosti darovat elektrony při různých činnostech kovů je jejich standardní potenciální hodnota . Pro vodík, respektive vodíkovou elektrodu, se předpokládá, že standardní potenciál je nulový. Standardní potenciál je elektromotorická síla článku složeného ze standardního vodíkového půlčlánku a druhého půlčlánku, ve kterém jsou koncentrace substrátů a produktů 1 mol/dm 3 .
| Elektroda | Standardní potenciál [V] |
| Li/Li + | -3.04 |
| Ca/Ca 2+ | -2,86 |
| Mg/Mg 3+ | -2,36 |
| Al/Al 3+ | -1,69 |
| Mn/Mn 2+ | -1,18 |
| Zn/Zn 2+ | -0,76 |
| Cr/Cr 3+ | -0,74 |
| Fe/Fe 2+ | -0,44 |
| Cd/Cd 2+ | -0,40 |
| Co/Co 2+ | -0,28 |
| Ni/Ni 2+ | -0,26 |
| Sn/Sn 2+ | -0,14 |
| Pb/Pb 2+ | -0,14 |
| Fe/Fe 3+ | 0,04 |
| H2 /2H + | 0,00 |
| Bi/Bi 3+ | +0,32 |
| Cu/Cu 2+ | +0,34 |
| Ag/Ag + | +0,80 |
| Hg/Hg 2+ | +0,85 |
| Au/Au 3+ | +1,52 |
Stůl 1 . Elektrochemická řada kovů Kovy viditelné v horní části řady jsou nejaktivnější. Ty nad vodíkem mají tendenci snadno oxidovat a jsou proto silnějšími redukčními činidly než vodík. Prvky pod vodíkem v sérii se snadněji redukují a jsou silnějšími oxidačními činidly. Pokud má kov negativnější potenciál než jiný, znamená to, že jej vytěsní ze své soli. Například železo vytlačí měď v solích mědi, ale měď nevytlačí železo ze svých solí. Místo toho může vytlačit stříbro ze stříbrných solí. Lithium a berylium z roztoků solí jiných kovů je nevytlačují, ale přímo reagují s vodou. Vytěsňují vodík a produkují své sloučeniny – hydroxidy . Takové kovy se nazývají aktivní kovy. Aktivita kovů a periodická tabulka prvků Stejně jako mnoho jiných vlastností lze chemickou aktivitu prvku odvodit z jeho pozice v periodické tabulce . Nejaktivnější kovy jsou ty ve skupinách I a II, protože snadno vytěsňují vodík z vody za vzniku hydroxidů. Ve skupině se chemická aktivita kovů zvyšuje s rostoucím atomovým číslem . Se zvyšujícím se atomovým číslem se perioda snižuje. 
Drahé a obecné kovy
Vodík poskytuje nejen referenční bod aktivity, ale také odděluje drahé a obecné kovy v řadě . Obecné kovy jsou ty nad vodíkem. Každý z nich reaguje s kyselinami a vytěsňuje z nich vodík. Od draslíku po vápník reagují s vodou již při pokojové teplotě a od hořčíku po železo s ní za zvýšené teploty. Všechny kovy, které jsou v řadě aktivit pod vodíkem , nevytěsňují vodík z kyselin . Mohou však reagovat s oxidujícími kyselinami za vzniku odpovídajících solí a oxidů , které vznikají redukcí kyselého zbytku. Prvky ve spodní části řady, od stříbra po zlato, jsou tak vysoce odolné vůči chemickým reakcím, že reagují pouze s aqua regia . Takovým roztokem je směs koncentrovaného roztoku kyseliny chlorovodíkové a koncentrovaného roztoku kyseliny dusičné (V) , smíchané v objemovém poměru 3:1. Když známe tyto skutečnosti, můžeme odvodit, že k rozlišení aktivity prvku lze provést několik reakcí: s vodou při pokojové teplotě, s horkou vodou, s neoxidační kyselinou, s oxidující kyselinou as aqua regia.
Experiment na detekci kovů vytěsňujících vodík z kyselin
Nejjednodušší způsob, jak potvrdit aktivitu kovu, je provést experiment. K tomu je třeba připravit deset zkumavek, do kterých se postupně umístí: v 1-5: hořčíková stuha, zinkový drát, železný drát, niklový drát a měděný drát. Stejné pořadí by se mělo opakovat ve zkumavkách 6-10. Přidejte několik mililitrů kyseliny chlorovodíkové do zkumavek 1-5 a několik mililitrů zředěné kyseliny sírové (VI) do zkumavek 6-10. Na každou trubici přiložte hořící dlahu. Ve zkumavkách, které obsahují hořčíkové pásky a železné, zinkové a niklové dráty, zaplavené kyselinami, se uvolňují bublinky plynu. Nejintenzivnější uvolňování lze pozorovat u zkumavek obsahujících hořčík. Reakce, které probíhají, jsou následující: 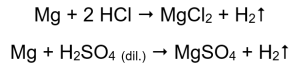 Množství emitovaného plynu klesá v řadě: zinek, železo, nikl. Podle toho probíhají následující reakce:
Množství emitovaného plynu klesá v řadě: zinek, železo, nikl. Podle toho probíhají následující reakce:  V trubkách, které obsahovaly měděné dráty, není vidět žádný plyn, žádná změna. To znamená, že k takovým reakcím nedochází:
V trubkách, které obsahovaly měděné dráty, není vidět žádný plyn, žádná změna. To znamená, že k takovým reakcím nedochází: 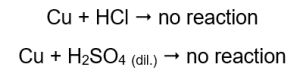 Při přiložení hořící dlahy se v trubicích, ze kterých vychází plyn, ozývá výrazný zvuk.
Při přiložení hořící dlahy se v trubicích, ze kterých vychází plyn, ozývá výrazný zvuk.
Shrnutí postřehů a závěrů:
Hořčík, zinek, železo a nikl reagují jak s kyselinou chlorovodíkovou, tak s kyselinou sírovou (VI). Každý z nich vytěsňuje vodík z kyseliny, což znamená, že jsou vyšší v řadě aktivity kovu než kyselina. Reakce produkují produkty ve formě solí a plynu, vodíku, který se uvolňuje. Výrazný zvuk, který doprovázel přiložení svítící dlahy na zkumavku unikajícího plynu, je způsoben reakcí vodíku s kyslíkem. Ze všech testovaných kovů je nejreaktivnější hořčík, následovaný zinkem, železem, niklem a mědí. Můžeme to říci, protože intenzita plynových bublin ukazuje na aktivitu kovu. U trubek obsahujících měď nebyly pozorovány žádné změny. To ukazuje, že měď není schopna vytěsnit vodík z kyseliny chlorovodíkové ani zředěné kyseliny sírové (VI).
