V případě chemických reakcí je úplná přeměna substrátů na produkty pozorována pouze u malé části z nich. Naprostá většina, včetně těch, které se vyskytují v našem těle, jsou reverzibilní. U takových procesů je ustaven stav chemické rovnováhy. Jde o nesmírně důležitý pojem v chemii, který je spojen například s Le Chatelierovým principem (neboli Zákonem rovnováhy). Znalost základních zákonů a principů týkajících se chemické rovnováhy umožňuje např. předpovídat mnoho reakcí nebo efektivněji provádět technologické procesy.
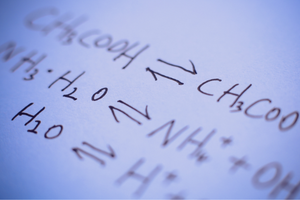
Reverzibilní a nevratné reakce
S přihlédnutím k průběhu chemických reakcí lze provést obecné rozdělení – na reakce vratné a nevratné. Je však třeba mít na paměti, že ve skutečnosti neexistují 100%nevratné reakce a zařazení do konkrétní skupiny je založeno na převažujícím výsledném efektu.
Nevratné reakce
V tomto případě substráty v systému reagují a výsledkem jsou specifické produkty. Nedochází však ke zpětné přeměně – produktů na substráty . Ve vzorci je mezi reaktanty označena jedna šipka a šipka ukazuje směrem k produktům. Nevratné reakce jsou především všechny ty, při kterých se tvoří sraženiny. V praxi jsou nerozpustné ve vodě a nelze je rekonstituovat. Reverzibilitu procesu je také obtížně dosažitelné v případě reakcí probíhajících v otevřených systémech, tj. v kádince nebo kulové baňce, ze které může některý z výsledných produktů, např. oxid uhličitý, volně unikat, ale změnou podmínek reakce, tj. jejím převedením do uzavřeného systému, ji lze učinit reverzibilní. Do skupiny nevratných reakcí patří také všechny procesy, kdy k interakci mezi molekulami produktu dochází v mnohem menší míře než mezi substráty. Takový proces tedy probíhá oběma směry, ale vzhledem k tomu, že rekonstituce substrátů je zanedbatelná, jsou v praxi klasifikovány jako nevratné reakce.
Reverzibilní reakce
Jedná se o reakce, při kterých vznikají produkty ze substrátů a zároveň dochází se srovnatelnou intenzitou ke zpětnému procesu – tedy k rekonstituci substrátů z produktů. V reakčním vzorci jsou mezi reaktanty umístěny dvě šipky, přičemž šipky ukazují v opačných směrech, aby indikovaly reverzibilitu probíhajících reakcí. Reverzibilní reakce jsou hlavně ty, které se provádějí v uzavřených systémech. Molekuly substrátů a produktů nejsou schopny opustit reakční prostředí a vzájemně se srážejí, vytvářejí produkty a rekonstituují substráty. Příkladem takové reakce je výroba jodovodíku z jódu a vodíku.
Stav chemické rovnováhy
Zda může dojít k určité reakci nebo zda je vratná či nevratná, závisí do značné míry na konkrétních podmínkách procesu a typu procesu. Pokud probíhá vratná reakce, tj. substráty se v důsledku chemické reakce mění na produkty a současně v důsledku srážek molekul produktu dochází k rekreaci substrátů, pak v určitém okamžiku, kdy tyto reakce nastanou, je ustaven stav chemické rovnováhy . Jinými slovy, koncentrace substrátů a produktů v systému jsou na konstantní úrovni – jejich množství se i přes nepřetržitou reakci nemění. V chemickém rovnovážném stavu jsou reakční rychlosti v obou směrech stejné. Chemická rovnováha za určitých podmínek znamená nejstabilnější stav pro konkrétní systém. Energetická náročnost je pak velmi nízká. Chemická rovnovážná konstanta K je koeficient, který popisuje rovnováhu dvou reverzibilních reakcí. Je definován jako podíl koncentrací produktů a substrátů zvýšených na mocniny odpovídající stechiometrickým koeficientům, které byly naměřeny v chemickém rovnovážném stavu. Vzorec pro konstantu byl odvozen v roce 1864 jako tzv. zákon hromadné akce. Je třeba mít na paměti, že se jedná o charakteristickou hodnotu pro konkrétní reakci. Stav chemické rovnováhy ovlivňuje řada faktorů. Toto jsou některé z nich:
- Teplota,
- objem reakčního systému,
- tlak,
- koncentrace reaktantů.
Důležité je, že poloha rovnovážného stavu není ovlivněna přidáním nebo změnou reakčního katalyzátoru. Jeho úkolem je pouze zkrátit dobu, během níž je dosaženo rovnováhy. 
Le Chatelierův princip (zákon rovnováhy)
Změnou určitých reakčních podmínek můžeme ovlivnit její rovnováhu. Systém bude vždy usilovat o udržení rovnováhy, protože je to pro něj energeticky příznivé (nejnižší energetický výdej). V důsledku toho dojde ke změnám, které budou působit proti faktorům, které vyvedou systém z rovnováhy. Tento jev byl vysvětlen v roce 1881 a dnes je znám jako Le Chatelier-Braunův princip nebo jako zákon rovnováhy. Umožňuje porozumět reakci systému na změny podmínek reakce, která je ve stavu chemické rovnováhy. Přídavek jedné z reagujících látek do systému způsobí narušení rovnováhy. Mění se koncentrace jednotlivých reaktantů. Aby se tomu zabránilo, systém má tendenci produkovat více produktu (když byl přidán substrát) nebo rekonstituovat substrát (když bylo přidáno určité množství produktu). Změna reakční teploty má obrovský dopad, zejména pro endotermické a exotermické procesy. V případě prvního je nutné dodávat energii do systému ve formě tepla, takže zvýšením teploty celého procesu se rovnováha posune doprava (snížením doleva), směrem k tvorbě dalšího produktu. . Opačně tomu bude u exotermických reakcí, kdy jedním z produktů je teplo. Teplota nemá žádný vliv na rovnováhu reakce, kde není pozorován žádný tepelný efekt. V případě reakcí probíhajících v plynné fázi je tlak velmi důležitým aspektem. Zvýšení hodnoty tohoto parametru, tj. snížení reakčního objemu systému, způsobí posun reakční rovnováhy. Směr změn závisí na stechiometrických koeficientech v reakční rovnici. Tento parametr neovlivní chemickou rovnováhu reakce, při které je součet stechiometrických koeficientů plynných substrátů a produktů stejný. Stojí za to připomenout, že když je systém vyhozen z chemické rovnováhy, bude platit zákon rovnováhy a v důsledku toho bude dosaženo nového stavu rovnováhy.
