Elektronegativita je veličina, která odráží tendenci daného atomu v molekule přitahovat elektrony k sobě. V praxi se jedná o schopnost atomu nebo funkčních skupin přitahovat elektronovou hustotu. Nejčastěji používaná stupnice spojená s touto veličinou je ta, kterou zavedl Linus Pauling, která umožňuje snadno vypočítat přibližnou povahu vazby.

Charakteristiky elektronegativity
Homonukleární molekuly, například H 2 a O 2 , mají ve svých molekulových orbitalech stejné koeficienty c A a c B , které lze zaznamenat jako vlnové funkce: Ψ +AB = c A Ψ A + c B Ψ B Ψ −AB = c A Ψ A − c B Ψ B V tomto případě je orbital charakteristický tím, že jeho tvar je symetrický vzhledem ke středu molekuly a jeho elektrický náboj je v něm rovnoměrně symetricky rozložen. Dalším příkladem jsou však heteronukleární molekuly, u kterých je prakticky nemožné zachovat stejné koeficienty, stejně jako plnou symetrii vzhledem ke středu molekuly. Když je energetická hladina atomového orbitalu Ψ B nižší než energetická hladina atomového orbitalu Ψ A , nastane vztah a maximum hustoty elektronové pravděpodobnosti se posune směrem k atomu B. V praxi to má za následek posun elektronu páru v chemické vazbě, tj. polarizace směrem k atomu B. Například v molekule hydridu lithného LiH je tento posun směrem k atomu vodíku, zatímco v molekule fluorovodíku HF k atomu fluoru. To znamená, že atom vodíku má nižší energetickou hladinu než lithium, ale vyšší energetickou hladinu než fluor (přečtěte si o halogenech ). Za těchto podmínek jeden z atomů obou molekul přebírá záporný náboj označovaný jako -δ a druhý je kladný +δ. Obecný vzorec takové molekuly je A + 8B -5 .
Náboje atomů
Výše uvedený náboj δ může nabývat různých hodnot v závislosti na prvcích vázaných chemickou vazbou . Jeho hodnota 0 znamená, že náboj elektronového páru je rozložen symetricky a pár se nachází zcela v blízkosti atomu s nižší energetickou hladinou, což má za následek přenos obou elektronů na tento atom. To vytváří iontovou vazbu mezi prvky. V naprosté většině chemických vazeb se však vyskytují zlomkové náboje, jejichž výsledkem je stav mezi kovalentní a iontovou vazbou.
Dipólový moment
Dipól je molekula, ve které lze rozlišit dva póly – kladný a záporný. Dipólový moment, označovaný μ, je mírou velikosti posunu elektrického náboje v něm. Je definován jako součin absolutní hodnoty elektrického náboje (δ) obsaženého v jednom z pólů a vzdálenosti od těchto pólů (l): μ = δ · l Kladný náboj (δ+) a záporný náboj ( δ-) se nazývá částečný náboj a jeho umístění je přisuzováno konkrétnímu atomu, ale ve skutečnosti jde pouze o větší či menší pravděpodobnost přítomnosti elektronu kolem jejich jader. Takový jev je někdy zaměňován s procesy oxidace a redukce , ale na rozdíl od změn, které v nich probíhají, takové náboje převzaté atomy nezpůsobí jejich přesun do jiného oxidačního stavu, takže mezi nimi nedochází k výměně elektronů. jim. Jednotkou SI pro vyjádření dipólového momentu je coulombmetr (C·m). Ve výpočtech se však nejčastěji používá jednotka zapsaná v systému CGS, debye (D). Jeden debye odpovídá hodnotě 3,33564·10 -30 C·m. Největší teoreticky možný dipólový moment charakterizuje molekuly s čistě iontovou vazbou. Nejmenší se přitom vyskytuje u molekul, jejichž vazba je čistě kovalentní – dipólový moment je v tomto případě nulový. Většinou se však jedná o přechodné případy s různými charaktery částic.
Halogenový dipólový moment
Na konkrétních chemických sloučeninách lze snadno pozorovat několik vztahů mezi elektronegativitou a dipólovým momentem. Tabulka 1 Dipólové momenty halogenovodíků
| Sloučenina | Experimentálně určený dipólový moment [ μ, D] | Délka vazby [pm] | Součin elementárního náboje a délky dipólu [e ·l, D] | Podíl iontového znaku [ %] | Rozdíl v elektronegativitě halogenu a vodíku |
| HF | 1,98 | 92 | 4.42 | 45 | 1.9 |
| HCl | 1.08 | 128 | 6.15 | 18 | 0,9 |
| HBr | 0,79 | 143 | 6,87 | 12 | 0,7 |
| AHOJ | 0,38 | 162 | 7,78 | 5 | 0,4 |
Poměr μ/(e·l’), tj. skutečný dipólový moment k dipólovému momentu, který odpovídá iontové vazbě, může poskytnout míru odchylek od plně kovalentní vazby. Součin tohoto vztahu ve tvaru (μ/(e·l’))·100 %představuje procento iontového charakteru ve vazbě. Toto je pouze přibližná hodnota, neboť dipólový moment závisí nejen na polaritě vazby, ale také na chování volných elektronových párů. Stává se, že elektronový mrak může být posunut ven z molekuly, což má za následek, že rovnice pro určení jeho dipólového momentu má další složku. V případě molekuly amoniaku je oblak nasměrován v souladu s dipólovým momentem vazby, což má za následek zvýšení výsledného dipólového momentu. Opačně je tomu naopak u molekuly oxidu uhelnatého, kde je mrak směrován opačným směrem a následně snižuje výsledný dipólový moment. 
Elektronegativita
Je to bezrozměrná empirická veličina, která odráží tendenci daného atomu v molekule přitahovat elektrony k sobě. V praxi se jedná o schopnost atomu nebo funkčních skupin přitahovat elektronovou hustotu. Nejčastěji používaná stupnice spojená s touto veličinou je ta, kterou zavedl Linus Pauling, která umožňuje snadno vypočítat přibližnou povahu vazby. Pro výpočet elektronegativity jednotlivých prvků použil vědec následující metodu: Předpokládáme, že D AA a D BB jsou vazebné energie dvouatomových molekul (A 2 , B 2 ). Vazebnou energii, která se vyskytuje v molekule, označujeme jako D AB . Empiricky bylo prokázáno, že pokud taková vazba obsahuje malý nebo žádný iontový charakter, je rozdíl mezi hodnotami D AB a geometrickým průměrem energetických hodnot D AA a D BB roven nebo blízký nule. Když má vazba AB jasné odchylky od kovalentního charakteru, nabývá tento rozdíl kladných hodnot, které se zvyšují se zvyšujícím se podílem iontového charakteru. Rozdíl mezi elektronegativitou (x) dvou atomů zapojených do vazby je vyjádřen vzorcem: ![]() Pokud tedy Pauling ve svých výpočtech předpokládal elektronegativitu fluoru 4,0, je možné vypočítat následné elektronegativity prvků. Pokud známe hodnotu x A atomů prvku A a hodnotu koeficientu Δ’, můžeme hodnotu x B vypočítat pomocí výše uvedené rovnice. Paulingova stupnice je konstruována tak, že její hodnoty přibližně souhlasí s hodnotami dipólového momentu vazby tvořené uvažovanými atomy, jak vidíme z příkladu v tabulce 1, který obsahuje hodnoty určené pro halogenovodíky. . Kromě výše popsaného měřítka je ve vědecké literatuře popsáno několik dalších, včetně elektronegativy popsané:
Pokud tedy Pauling ve svých výpočtech předpokládal elektronegativitu fluoru 4,0, je možné vypočítat následné elektronegativity prvků. Pokud známe hodnotu x A atomů prvku A a hodnotu koeficientu Δ’, můžeme hodnotu x B vypočítat pomocí výše uvedené rovnice. Paulingova stupnice je konstruována tak, že její hodnoty přibližně souhlasí s hodnotami dipólového momentu vazby tvořené uvažovanými atomy, jak vidíme z příkladu v tabulce 1, který obsahuje hodnoty určené pro halogenovodíky. . Kromě výše popsaného měřítka je ve vědecké literatuře popsáno několik dalších, včetně elektronegativy popsané:
- Mulliken, jehož práce předpokládala, že elektronegativita prvku je přímo úměrná součtu jeho elektronové afinity a ionizační energie. Elektronová afinita, což je množství energie, která se uvolní v důsledku připojení elektronu k neutrálnímu atomu, a ionizační energie rovna množství energie potřebné k oddělení elektronu od neutrálního atomu. Nejvyšší elektronegativity jsou proto charakteristické pro atomy, které vykazují vysokou elektronovou afinitu a vysokou ionizační energii.
- Allred a Rochow, kteří předpokládali úměrnost elektronegativity k míře síly, kterou atomové jádro (Z) působí na valenční elektrony, zaznamenané jako
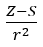 (r – atomový poloměr, S – stínící konstanta). Podle jejich teorie lze elektronegativitu (x) prvků vypočítat pomocí vzorce:
(r – atomový poloměr, S – stínící konstanta). Podle jejich teorie lze elektronegativitu (x) prvků vypočítat pomocí vzorce:
![]() Na každé stupnici se elektronegativita vodíku blíží hodnotě 2,2, ostatní hodnoty se mírně liší. Příklady elektronegativit elementárních atomů vypočtené podle Paulingovy, Mullikenovy a Allredovy a Rochowovy stupnice jsou uvedeny v tabulce 2 níže. Tabulka 2 Elektronegativity ukázkových prvků na stupnici Pauling (P), Mulliken (M) a Allred a Rochow (AR)
Na každé stupnici se elektronegativita vodíku blíží hodnotě 2,2, ostatní hodnoty se mírně liší. Příklady elektronegativit elementárních atomů vypočtené podle Paulingovy, Mullikenovy a Allredovy a Rochowovy stupnice jsou uvedeny v tabulce 2 níže. Tabulka 2 Elektronegativity ukázkových prvků na stupnici Pauling (P), Mulliken (M) a Allred a Rochow (AR)
| Atom | P | M | AR |
| F | 3,98 | 3,90 | 4.10 |
| Ó | 3.44 | 3.04 | 3,50 |
| N | 3.04 | 2.28 | 3.07 |
| Cl | 3.16 | 2,95 | 2,83 |
| C | 2.55 | 1,75 | 2,50 |
| H | 2.20 | 2.21 | 2.20 |
| Si | 1,90 | 2.25 | 1,74 |
| F | 0,82 | 0,77 | 0,91 |
| Rb | 0,82 | 0,50 | 0,89 |
| Čs | 0,79 | – | 0,86 |
| Fr | 0,70 | – | 0,86 |
Navzdory nesrovnalostem ve výpočtech s těmito třemi metodami má fluor nejvyšší elektronegativitu v každém měřítku, následovaný kyslíkem, dusíkem a chlorem . Nejnižší hodnoty byly stanoveny pro francium, cesium, rubidium a draslík. Prvky, které jsou typicky nekovy, mají elektronegativitu vyšší než 2, typické kovy mají elektronegativitu nižší než 2. Standardní hodnotou je již zmíněná elektronegativita vodíku přibližně 2,2. 
Elektronegativita v periodické tabulce
Stejně jako mnoho jiných vlastností se elektronegativita odráží také v uspořádání chemických prvků v periodické tabulce . Ve skupině elektronegativita klesá s rostoucím počtem skořepin a kovovým charakterem, takže roste směrem od francia k vodíku. Postupem času se elektronegativita zvyšuje s nárůstem přítomných valenčních elektronů a zmenšováním nekovového charakteru, takže od kovů k vzácným plynům .
Elektronegativita a typ vazby – shrnutí
Tím, že známe jednotlivé hodnoty elektronegativity prvků tvořících chemickou vazbu, můžeme odvodit její povahu. Pokud je rozdíl mezi 0,0 a 0,4, je vazba kovalentní. Když je rozdíl mezi 0,4 a 1,7, vazba je polarizovaná kovalentní. Rozdíl nad 1,7 v elektronegativitě prvků naznačuje iontovou vazbu.
