Disociace v chemickém kontextu znamená rozklad látky na jiné molekuly. Slovo pochází z latinského výrazu „ dissociatio “, což znamená „oddělení“. Ve vědecké nomenklatuře má disociace různé definice, protože má také svůj specifický význam v psychologii. Ale zaměřme se na to, co znamená disociace v chemii. Podle průběhu procesu a použité látky můžeme rozlišit čtyři různé typy disociace. Nejoblíbenější je elektrolytická disociace, i když tepelná disociace je stejně důležitá.

Tepelná disociace
Proces spočívá v rozkladu molekul na menší molekuly nebo na atomy, pod vlivem teploty. Nejdůležitějším vztahem je skutečnost, že teplota použitá pro disociaci může být nižší, pokud sloučenina obsahuje slabší chemické vazby. Ty s vyšší energií nutnou k rozkladu vyžadují vyšší teplotu. Běžným příkladem termolýzy (tepelné disociace) je karamelizace sacharózy, ke které dochází při 160 ° C.
Elektrolytická disociace
Objevil ho v roce 1887 švédský chemik Svante Arrhenius a je poněkud složitější ve srovnání s tepelnou disociací. Elektrolytická disociace spočívá v rozkladu látky, ke kterému dochází, když rozpouštědlo (obvykle voda) ovlivňuje volně se pohybující ionty. Arrhenius ve svém výzkumu dokázal, že ionty produkované takovou disociací způsobují, že roztok vede elektřinu. To byl základ pro vývoj klasifikace chemických látek na elektrolyty (roztoky schopné vést elektrický proud) a neelektrolyty (roztoky neschopné vést elektrický proud).
Elektrolyty
Pojem „elektrolyty“ má dva významy – z technického hlediska je to jakákoliv látka, která může iontově přenášet náboj mezi elektrodami. V důsledku toho může iontově vést elektrický proud. Druhý, více chemický význam tohoto termínu se týká látek, které podléhají elektrolytické disociaci v důsledku tání nebo rozpouštění. Takové roztoky (nejčastěji vodné) také vedou elektrický proud. Příklady takových elektrolytů zahrnují iontové sloučeniny, jako je chlorid sodný (stolní sůl), ale také neiontové sloučeniny, například kyselina chlorovodíková nebo hydroxid draselný . Vzhledem k jejich specifickým vlastnostem lze elektrolyty nazvat elektrickými vodiči. Ty lze rozdělit na vodiče třídy 1 (kovy, jejich slitiny a uhlík) a vodiče třídy 2 (roztoky zásad, kyselin a solí ).
Mechanismus elektrolytické disociace
V rozpouštědle, jehož dielektrická konstanta je vysoká (např. 81 pro vodu), jsou síly vzájemné přitažlivosti mezi ionty v krystalické síti značně sníženy. Tehdy se ionty odlomí, což způsobí rozpuštění látky a vylučování volně se pohybujících iontů do roztoku. K takovým procesům dochází také v důsledku interakce mezi ionty a molekulami vody, což je důsledek polární struktury H 2 O. Mechanismus působení vody při rozkladu elektrolytu s iontovou strukturou je podle Nekrasova nastartován kladný iont látky, který přitahuje opačný pól molekuly vody a zároveň kladný ion odtlačuje. Opačný pól působí stejným způsobem a oba ionty jsou obklopeny molekulami vody, které přitáhly. K takové přitažlivosti dochází v obou směrech mezi dipolárními molekulami a ionty, což činí přitažlivou sílu iontů v elektrolytu mnohem nižší. Mechanismus lze tedy rozdělit do čtyř hlavních fází: přechod polární do iontové struktury, vytvoření iontové struktury a hydratace iontů. Vazby mezi ionty a rozpouštědlem vzniklé disociací se nazývají solváty. Pokud je rozpouštědlem voda, pak se nazývají hydráty.
Hydratační skořápka
Je to obal složený z molekul vody existujících v nejbližší blízkosti iontu, orientovaných svými protipóly. Volné nabité póly přitahují další vodní vrstvy, dokud se přitažlivá síla iontu nestane slabší než molekulární pohybová energie v roztoku. Plášť usnadňuje rozklad molekul elektrolytu na kationty a anionty a tvoří bariéru, která brání opětovnému spojení iontů za vzniku molekul. 
Disociace kyselin a zásad: zákon hromadného působení
Silné kyseliny jsou kyseliny, které vykazují dalekosáhlou disociaci ve vodném roztoku, a slabé kyseliny jsou ty, které disociují pouze v malé míře. Pokud porovnáme sílu různých kyselin, měli bychom vzít v úvahu také několik faktorů, jako je tendence molekul kyseliny uvolňovat své protony nebo koncentrace příslušné látky. Existuje však chemická hodnota, která nezávisí na koncentraci, ale výborně charakterizuje jednotlivé vlastnosti molekul – disociační konstanta. Odvození rovnice pro tuto hodnotu by mělo začít napsáním rovnice pro disociaci kyseliny . Pro příklad s jedním protonem (HX) to bude vypadat takto: ![]() Pokud je roztok zředěný a kyselina je slabá, můžeme použít zákon hmotnostního působení, který je vyjádřen takto:
Pokud je roztok zředěný a kyselina je slabá, můžeme použít zákon hmotnostního působení, který je vyjádřen takto: 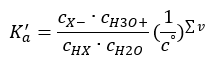 Existují dva způsoby, jak zkrátit prezentovaný vztah. Prvním krokem je předpokládat, že koncentrace vody je konstantní. Symbol c o můžeme také vynechat, protože vyjadřuje standardní koncentraci rovnou 1 mol/dm 3 . Je však důležité jej umístit do výchozího vzorce a zohlednit ho při určování jednotky. Chemické konstanty jsou totiž bezrozměrné hodnoty. Mezitím jsou všechny koncentrace použité ve vzorci vyjádřeny v mol/dm 3 . Pak konečně získáme vzorec pro disociační konstantu:
Existují dva způsoby, jak zkrátit prezentovaný vztah. Prvním krokem je předpokládat, že koncentrace vody je konstantní. Symbol c o můžeme také vynechat, protože vyjadřuje standardní koncentraci rovnou 1 mol/dm 3 . Je však důležité jej umístit do výchozího vzorce a zohlednit ho při určování jednotky. Chemické konstanty jsou totiž bezrozměrné hodnoty. Mezitím jsou všechny koncentrace použité ve vzorci vyjádřeny v mol/dm 3 . Pak konečně získáme vzorec pro disociační konstantu: 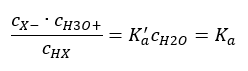 Vztah vyjadřující kyselou disociační konstantu (K a ) sestává z experimentálně zjištěných hodnot, které spadají do rozmezí 10 -10 až 10 8 . Oblíbenou operací je použití logaritmického vzorce, vyjádřeného jako záporný logaritmus disociační konstanty, označený jako pKa : pKa = -logKa Je důležité, že zatímco nízké hodnoty K a představují slabé kyseliny, vysoké hodnoty představují silné kyseliny. , pKa se mění opačně. Nízké, obvykle negativní hodnoty pKa odpovídají silným kyselinám. Pozitivní, vysoké hodnoty pKa představují slabé kyseliny. Když zavedeme další pojem, stupeň disociace (α), což je poměr počtu molů molekul dané sloučeniny, které podléhají disociaci (rozkladu na ionty), k celkovému počtu molů molekul dané sloučeniny. že sloučenina přítomná v roztoku, můžeme rovnici dále rozvíjet. Pokud odhlédneme od velmi nízké koncentrace vodíkových iontů vzniklých disociací vody a použijeme rovnovážné koncentrace iontů a molekul, můžeme předpokládat, že:
Vztah vyjadřující kyselou disociační konstantu (K a ) sestává z experimentálně zjištěných hodnot, které spadají do rozmezí 10 -10 až 10 8 . Oblíbenou operací je použití logaritmického vzorce, vyjádřeného jako záporný logaritmus disociační konstanty, označený jako pKa : pKa = -logKa Je důležité, že zatímco nízké hodnoty K a představují slabé kyseliny, vysoké hodnoty představují silné kyseliny. , pKa se mění opačně. Nízké, obvykle negativní hodnoty pKa odpovídají silným kyselinám. Pozitivní, vysoké hodnoty pKa představují slabé kyseliny. Když zavedeme další pojem, stupeň disociace (α), což je poměr počtu molů molekul dané sloučeniny, které podléhají disociaci (rozkladu na ionty), k celkovému počtu molů molekul dané sloučeniny. že sloučenina přítomná v roztoku, můžeme rovnici dále rozvíjet. Pokud odhlédneme od velmi nízké koncentrace vodíkových iontů vzniklých disociací vody a použijeme rovnovážné koncentrace iontů a molekul, můžeme předpokládat, že: 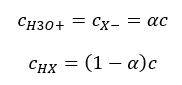 Pak lze disociační konstantu zaznamenat takto:
Pak lze disociační konstantu zaznamenat takto:  V této podobě jde o závislost stupně disociace elektrolytu od jeho koncentrace, tj. Ostwaldův zákon ředění. Pokud analyzujeme velmi slabé elektrolyty, lze stupeň disociace (α) předpokládat jako <<1 a vzorec lze zjednodušit na následující:
V této podobě jde o závislost stupně disociace elektrolytu od jeho koncentrace, tj. Ostwaldův zákon ředění. Pokud analyzujeme velmi slabé elektrolyty, lze stupeň disociace (α) předpokládat jako <<1 a vzorec lze zjednodušit na následující:  Kyseliny, které obsahují více než jeden proton, procházejí vícestupňovou disociací a musíme vzít v úvahu všechny její fáze. Abychom uvedli příklad, pro kyselinu ortofosforečnou existují tři fáze:
Kyseliny, které obsahují více než jeden proton, procházejí vícestupňovou disociací a musíme vzít v úvahu všechny její fáze. Abychom uvedli příklad, pro kyselinu ortofosforečnou existují tři fáze:
- H3P04 + H20 = H2P04- + H30 +
- H2PO4- + H20 = HPO42- + H30 +
- HPO42- + H20 = P043- + H30 +
Každý stupeň má svou vlastní rovnovážnou konstantu, kterou lze zaznamenat analogicky jako první:  Disociační konstanty jsou uvedeny v tabulkách, a to jak pro hydracid, tak pro oxykyseliny.
Disociační konstanty jsou uvedeny v tabulkách, a to jak pro hydracid, tak pro oxykyseliny.
| Kyselina | K a | pK a |
| HF | 6,3· 10-4 | 3.2 |
| HCl | 1·10 7 | -7 |
| HNO 3 | 27,54 | -1,44 |
| H3PO4 _ | 6,9· 10-3 | 2.16 |
Tabulka 1. Příklady hodnot disociačních konstant pro kyseliny. Podobné je to u stabilizace rovnováhy bází při disociaci. Vzhledem k příkladu pravidla B lze rovnici poznamenat takto: ![]() Pak, pokud chceme odvodit disociační konstantu pro bázi pomocí zákona o působení hmoty a za předpokladu, že koncentrace vody ve zředěném roztoku je prakticky konstantní, dostaneme následující vzorec:
Pak, pokud chceme odvodit disociační konstantu pro bázi pomocí zákona o působení hmoty a za předpokladu, že koncentrace vody ve zředěném roztoku je prakticky konstantní, dostaneme následující vzorec:  Čím silnější je báze, tím vyšší je disociační konstanta a nižší hodnota pKb , zatímco čím nižší je disociační konstanta a čím vyšší je hodnota pKb , tím je báze slabší.
Čím silnější je báze, tím vyšší je disociační konstanta a nižší hodnota pKb , zatímco čím nižší je disociační konstanta a čím vyšší je hodnota pKb , tím je báze slabší.
| Základna | K b | pK b |
| Hydrazin | 3· 10-6 | 5.5 |
| Amoniak | 1,78-10-5 | 4,75 |
| methylamin | 5,0-10-4 | 3.3 |
Tabulka 2. Příklady hodnot disociačních konstant pro báze. 
Co určuje sílu kyselin
Pokud známe výrazy disociačních konstant pro konkrétní kyseliny, můžeme učinit několik pravdivých předpokladů:
- Síla hydracidů roste spolu s rostoucím atomovým číslem prvku spojeného s atomem vodíku.
- Síla hydracidů klesá spolu s rostoucí elektronegativitou prvku připojeného k atomu vodíku. To může být zavádějící, protože teoreticky by rostoucí elektronegativita měla upřednostňovat abstrakci protonů.
- Velikost aniontu vzniklého při disociaci ovlivňuje disociační konstantu ve větší míře než elektronegativita.
Samodisociace vody
Zajímavým příkladem disociace je rozklad molekul vody. Protože jsou schopny protony přitahovat i rozdávat, podléhá čistá voda v malé míře samodisociaci podle následující rovnice: H 2 O + H 2 O ↔ H 3 O + + OH – Podobně jako u kyselin a bází, je také možné aplikovat zákon hromadného působení, který zahrnuje rovnovážné koncentrace nedisociované vody i jejích aniontů a kationtů: 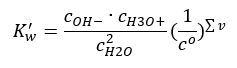 Ukazuje se, že koncentrace kationtů H 3 O + a OH – aniontů jsou ve srovnání s nedisociovanou vodou tak malé, že ani jejich alterace prakticky nemění koncentraci nedisociované vody. To umožňuje předpokládat, že hodnota je konstantní a převést rovnici do následujícího tvaru: K w = c OH – · c H3O + Je to zvláště důležitý aspekt v kontextu chemických výpočtů a taková konstanta je označována až jako iontový produkt vody. Často se také používá jako záporný logaritmus, označený jako pKw . To se rovná –logK w . Z rovnice vyplývá, že pokud dojde k narušení iontové rovnováhy vody v důsledku dodávky iontů H 3 O + , pak pro udržení stálosti iontového produktu musíme snížit koncentraci iontů OH – . Podobně přebytek OH – iontů snižuje koncentraci kationtů. Součin těchto koncentrací musí být konstantní. Experimenty ukázaly, že Kw při teplotě 298 K je 10-14 . Můžeme si tedy také všimnout rovnice platné pro čistou vodu takto:
Ukazuje se, že koncentrace kationtů H 3 O + a OH – aniontů jsou ve srovnání s nedisociovanou vodou tak malé, že ani jejich alterace prakticky nemění koncentraci nedisociované vody. To umožňuje předpokládat, že hodnota je konstantní a převést rovnici do následujícího tvaru: K w = c OH – · c H3O + Je to zvláště důležitý aspekt v kontextu chemických výpočtů a taková konstanta je označována až jako iontový produkt vody. Často se také používá jako záporný logaritmus, označený jako pKw . To se rovná –logK w . Z rovnice vyplývá, že pokud dojde k narušení iontové rovnováhy vody v důsledku dodávky iontů H 3 O + , pak pro udržení stálosti iontového produktu musíme snížit koncentraci iontů OH – . Podobně přebytek OH – iontů snižuje koncentraci kationtů. Součin těchto koncentrací musí být konstantní. Experimenty ukázaly, že Kw při teplotě 298 K je 10-14 . Můžeme si tedy také všimnout rovnice platné pro čistou vodu takto:  Disociace také souvisí s hodnotou pH roztoku. Roztoky se stejnými koncentracemi kationtů H 3 O + a aniontů OH – vykazují neutrální pH. V kyselých roztocích je koncentrace kationtů vyšší než 10 -7 mol/l, zatímco v alkalických roztocích je nižší než 10 -7 mol/l.
Disociace také souvisí s hodnotou pH roztoku. Roztoky se stejnými koncentracemi kationtů H 3 O + a aniontů OH – vykazují neutrální pH. V kyselých roztocích je koncentrace kationtů vyšší než 10 -7 mol/l, zatímco v alkalických roztocích je nižší než 10 -7 mol/l.
