Energie chemických reakcí je jedním z důležitých prvků, které nám umožňují porozumět přeměnám, ke kterým při chemické reakci dochází. Během takové transformace vznikají chemické sloučeniny se strukturou a chemickým složením odlišným od surovin, ze kterých jsou vyrobeny. V průběhu chemické reakce se přeruší vazby existující mezi atomy molekul použitých jako reaktanty a vytvoří se nové vazby – přítomné v produktech.

Systém a prostředí chemické reakce
Pro správnou interpretaci chemické reakce z hlediska energie potřebujeme mít určité znalosti o následujícím:
- Systém: oddělená oblast hmoty s jasnými hranicemi. Důležitý je typ systému: je otevřený, pokud reakce zahrnuje výměnu energie a hmoty, uzavřený, pokud reakce zahrnuje pouze výměnu energie, nebo izolovaný, pokud nedochází k výměně energie ani hmoty.
- Prostředí: cokoli, co není součástí systému, ale nachází se poblíž.
- Složky systému: všechny látky, které se nacházejí v analyzovaném systému a mají své charakteristické chemické vlastnosti.
Energie chemických vazeb
Energetický efekt, který charakterizuje jakoukoli chemickou reakci, je výsledkem změn, ke kterým dochází při přerušování a vytváření nových vazeb mezi atomy. Faktem je, že každé přerušení chemické vazby je bytostně spojeno s absorpcí příslušného množství energie, zatímco vznik nové vazby způsobuje produkci energie. Uvolňování energie do prostředí může mít různé účinky: teplo, světlo, práce nebo elektřina. Každý z těchto procesů je komponentním faktorem, který ovlivňuje obecnou změnu vnitřní energie systému, ve kterém reakce probíhá. Je důležité, že bez ohledu na to, zda činidla musí během transformace čerpat nebo odevzdávat energii, je k zahájení celého procesu vždy zapotřebí určité množství energie.
První zákon termodynamiky
Prvním důležitým pravidlem týkajícím se energie chemických reakcí je vztah formulovaný v prvním termodynamickém zákonu, který říká, že vnitřní energie systému, který pouze vyměňuje energii s okolím (uzavřený systém), může být přeměněna pouze na teplo nebo práci. To se odráží v Helmholtzově rovnici: ∆U = Q + W Kde ΔU označuje změnu vnitřní energie, Q označuje teplo a W označuje práci. Ze vzorce si můžeme všimnout, že vnitřní energie izolovaného systému, tj. takového, který si nevyměňuje energii ani hmotu s okolím, je konstantní. Složkami vnitřní energie jsou všechny kinetické energie atomů, iontů, molekul, elektronů a složek atomového jádra, které se aktuálně nacházejí v reakčním systému, a také energie jejich interakcí, tedy energie chemických vazeb, interakcí. mezi poplatky a tak dále. Upozorňujeme, že vnitřní energie neobsahuje kinetickou ani potenciální energii systému jako celku. Součet kinetických a potenciálních energií systému jako celku a vnitřní energie je celková energie systému (E).
Systémová entalpie (H)
Jde o další důležitý pojem související s energií chemických reakcí, což v praxi znamená součet vnitřní energie systému a součin jeho tlaku a objemu. V kvalitativním vyjádření je to energie potřebná k výrobě systému ve vakuu (U), zvýšená o práci, tj. podíl tlaku a objemu (pV), kterou musí systém vykonat proti vnějším silám, aby dosáhl objemu odlišného od nula. Vztah definující entalpii systému je vyjádřen následovně: H = U + pV Reakce probíhající v takovém systému způsobí nekonečně malou změnu entalpie: dH = dU + dpV + pdV Pokud jsou reakční podmínky izobarické, tak pokud tlak během proces se nemění, druhou část lze vynechat, protože dpV=0. Po dosazení diferenciálů za určité přírůstky a po nahrazení výrazu týkajícího se změny vnitřní energie systému získáme následující vztah: ∆H = Q + W + p∆V Za předpokladu, že analyzovaný proces vykonává objemovou práci při konstantním tlaku. , pak W = -pΔV a následně: ∆H = Q – p∆V + p∆V Z rovnice vyplývá, že pokud reakce probíhá za konstantního tlaku, pak se změna entalpie systému rovná teplu: ∆H = Q
Energetické schopnosti reakce
Na základě výše odvozeného vzorce, který ukazuje, že změna entalpie systému se může rovnat reakčnímu teplu, jsou procesy klasifikovány podle tepelných přeměn. Z hlediska směru toku energie dělíme chemické reakce na:
- Exotermické reakce, což jsou takové reakce, kdy můžeme pozorovat emisi energie, například ve formě tepla, do okolí systému. K tomu dochází, když je součet entalpií produktů nižší než součet entalpií substrátů, tedy když ΔH<0.
- Endotermické reakce, tedy takové chemické reakce, které způsobují absorpci energie z prostředí. Podmínkou takové reakce je dodat odpovídající množství této energie. To platí pro všechny přeměny, u kterých je celková entalpie produktů vyšší než celková entalpie substrátů, tedy ΔH>0.
Zápisy chemických reakcí
Vzhledem k chemickým reakcím spolu s jejich potřebou energie a distribucí jsou jejich specifické tepelné účinky zahrnuty v zápisu chemické rovnice. U exotermických reakcí je absolutní hodnota stávajícího tepelného efektu uvedena na straně produktu. Naopak, když se zaznamenává endotermická reakce, absolutní hodnota absorbované energie je zaznamenána na straně substrátu. Uvedu příklad:
- Exotermická reakce:
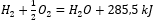
- Endotermická reakce: 2H 3 PO 4 + 3 Mg(OH) 2 + 407 kJ = Mg 3 (PO 4 ) 2 + 6H 2 O
Dalším způsobem je poznamenat si chemickou rovnici spolu s hodnotou energetického efektu uvedenou stranou. V tomto případě je hodnota představující energii exoenergické reakce záporná, zatímco pro endoenergickou reakci je kladná. Například:
- Exoenergická reakce: Fe + S → FeS ∆H= -95,2 kJ/mol
- Endoenergická reakce: FeS → Fe + S ∆H= 95,2 kJ/mol
Hessův zákon
Představuje základ pro termochemické výpočty a uvádí, že tepelný efekt je vždy stejný bez ohledu na způsob, jakým se reakce provádí. To nám umožňuje vypočítat standardní entalpii reakce (Δ r H ϴ ), za předpokladu použití standardních podmínek, tj. tlaku 10 5 Pa a libovolné teploty. Vzhledem k tomu, že entalpie je funkcí stavu, závisí její variabilita pouze na dvou hodnotách: v počátečním a konečném stavu, který v chemické reakci představuje stav substrátů a stav produktů. Hessův zákon je vyjádřen rovnicí, která obsahuje stechiometrické koeficienty (v) a standardní molární entalpie tvorby (Δ f H ϴ ): 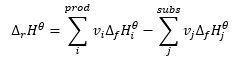
Standardní molární entalpie tvorby
Je to entalpie získaná vytvořením 1 molu konkrétní chemické sloučeniny z prvků v jejich bazických stavech. Základní stav je nejodolnější variantou prvku ve specifických podmínkách. Uvedu příklad, grafit je nejodolnější variantou uhlíku při 25 o C a 10 5 Pa. Naopak při vysoké teplotě a tlaku je stabilní formou uhlíku diamant. Pro každý reaktant, který se účastní reakce ve svém základním stavu, je hodnota standardní molární entalpie tvorby nula. Obvykle se jedná o jednotlivé atomy vzácných plynů nebo o nejodolnější varianty jiných plynů ve specifických podmínkách. Pro standardní tlak (10 5 Pa) a teplotu (běžně 25 o C) jsou hodnoty standardních molárních entalpií tvorby sloučenin shrnuty v chemických tabulkách. Jednotkou této hodnoty je . Hessův zákon aplikovaný na chemické reakce znamená, že hodnota entalpie reakce je nezávislá na počtu mezilehlých reakcí. Jedinou klíčovou informací je, že k získání konkrétních produktů se používají konkrétní substráty.
Syntéza oxidu uhličitého
Syntéza oxidu uhličitého může být provedena různými způsoby, ale podle Hessova zákona každý z nich vede ke stejné hodnotě změn standardních entalpií.
- Přímá syntéza
- Syntéza oxidu uhlíku (II) + oxidace sloučeniny na oxid uhlíku (IV).
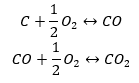 Když z tabulky odečteme hodnoty standardních entalpií vzniku sloučenin a dosadíme je do chemických rovnic, uvidíme, že entalpie pro každou metodu je stejná: -393,5 kJ/mol.
Když z tabulky odečteme hodnoty standardních entalpií vzniku sloučenin a dosadíme je do chemických rovnic, uvidíme, že entalpie pro každou metodu je stejná: -393,5 kJ/mol.
Kirchhoffův zákon
Umožňuje nám transformovat výpočty tak, abychom vypočítali standardní entalpii reakce pro určitou teplotu, pokud známe její hodnotu při jiné teplotě. Známe také vztahy mezi molárním teplem všech reaktantů a teplotou. Zákon lze použít, protože změna entalpie reakce závisí na podmínkách, ve kterých byla určena: mění se spolu s měnící se teplotou a tlakem. Odvození vzorce by mělo začít definováním tepelné kapacity, což je poměr dodaného tepla k nárůstu teploty: ![]() Za předpokladu izotermických podmínek můžeme provést následující transformaci:
Za předpokladu izotermických podmínek můžeme provést následující transformaci: ![]() Integraci výsledné rovnice a převod tepelné kapacity na část představující změnu standardní tepelné kapacity odráží rovnice, kterou poskytuje Kirchhoffův zákon:
Integraci výsledné rovnice a převod tepelné kapacity na část představující změnu standardní tepelné kapacity odráží rovnice, kterou poskytuje Kirchhoffův zákon: 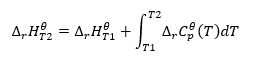 Pro standardní podmínky je změna tepelné kapacity reakce definována rovnicí s v-proměnnými, což jsou stechiometrické faktory, a , což představuje standardní molární teplo daného reaktantu. Když je rozdíl teplot malý (do 100 K), předpokládá se, že hodnota standardního molárního tepla reaktantu je v určitém rozsahu konstantní. Pak můžeme použít zjednodušenou formu Kirchhoffova zákona za předpokladu, že tepelné kapacity reaktantů nezávisí na teplotě, ale na konstantním tlaku, :
Pro standardní podmínky je změna tepelné kapacity reakce definována rovnicí s v-proměnnými, což jsou stechiometrické faktory, a , což představuje standardní molární teplo daného reaktantu. Když je rozdíl teplot malý (do 100 K), předpokládá se, že hodnota standardního molárního tepla reaktantu je v určitém rozsahu konstantní. Pak můžeme použít zjednodušenou formu Kirchhoffova zákona za předpokladu, že tepelné kapacity reaktantů nezávisí na teplotě, ale na konstantním tlaku, : ![]()
