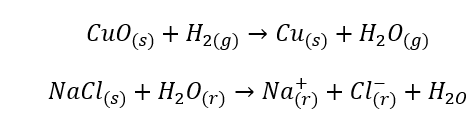Úvahy o různých jevech a procesech musí být mnohovrstevnaté. Měli bychom brát v úvahu jak mikroskopické, tak makroskopické vlastnosti. Jak názvy napovídají, toto dělení se provádí řádovým oddělením analyzovaných položek. Makroskopická doména, úzce spojená s termodynamikou chemických reakcí, nám umožňuje pozorovat a měřit fyzikální a chemické vlastnosti, jako je hustota, teplota nebo rozpustnost. Pomocí mikroskopické analýzy můžeme pozorovat pohyby a interakce molekul. Molekuly můžeme popsat z hlediska jejich rychlosti a kinetické energie. Pokud nás zajímá směs, můžeme vzít v úvahu její homogenitu a následně typ systému, ve kterém existuje.

Klasifikace fyzikálně-chemických systémů
Při analýze homogenity materiálových systémů je makroskopická škála klasifikuje do dvou hlavních skupin: homogenní a heterogenní systémy. Tato kategorizace je založena na jejich fyzikálních vlastnostech: fyzikální stav, rozpustnost a bod tání, které se mohou nebo nemusí lišit. Každý systém zahrnuje všechny látky, které se účastní určité reakce nebo procesu. Část systému, která jasně vyniká zachováním stejných vlastností, se nazývá fáze. Existují tři různé typy fází: pevná, kapalná a plynná. Povrch umístěný mezi nimi a zbytkem systému se nazývá rozhraní. V závislosti na volné entalpii (ΔG) nebo entropii (ΔS), pokud ΔS>0 nebo ΔG<0, může přeměna jedné fáze na druhou probíhat automaticky.
Diagram fázové rovnováhy
Grafické znázornění existence různých fází se nazývá fázový rovnovážný diagram. Zahrnuje existenci specifických fází (při dosažení určitých teplotních a tlakových rozsahů) a jejich vzájemné přeměny. Schématický fázový rovnovážný diagram pro jednosložkový systém ilustruje existenci tří hlavních fází v závislosti na podmínkách procesu. Čáry, které ukazuje, označují stavy rovnováhy mezi dvěma příslušnými fázemi, tj. mezi pevnou látkou a plynem, mezi pevnou látkou a kapalinou a mezi plynem a kapalinou. Pokud tedy známe jeden z kritických parametrů, můžeme určit podmínky, které způsobí tání, zamrzání, vypařování, kondenzaci, sublimaci nebo resublimaci příslušné složky. Kromě toho diagram obsahuje trojitý bod, kde se všechny fázové linky spojují, což znamená, že všechny tři fáze mohou koexistovat za specifikovaných podmínek. Diagram také obsahuje dva důležité body: kritický tlak a kritickou teplotu. Kritický tlak je indikován bodem představujícím maximální tlak, při kterém můžeme kapalinu přeměnit na plyn, nebo maximální možný tlak syté páry nad kapalinou. Koncept kritické teploty definuje nejvyšší teplotu, při které může plyn kondenzovat při zvyšování tlaku. Kritický bod existující za podmínek kritické teploty a kritického tlaku tedy definuje stav, ve kterém není možné rozlišit kapalnou a plynnou fázi.
Gibbsovo fázové pravidlo
Je to specifický vztah, který lze aplikovat na jakýkoli systém existující v termodynamické rovnováze. Rovnice představující toto pravidlo obsahuje počet fází (f) přítomných v systému s počtem nezávislých složek (n) a počtem stupňů volnosti (s). Číslo s odpovídá množství nastavitelných intenzivních veličin, které při změně nenaruší počet fází v rovnováze izolované soustavy. Intenzivní proměnné jsou jakékoli fyzikální veličiny, které v žádném případě nezávisí na systému (např. geometrické velikosti nebo objemu) nebo na počtu jeho molekul, jeho hmotnosti, měrném teple atd. Rovnice je následující: Nezávislé složky systému , označené jako n, prakticky představují nejnižší počet systémových komponentů potřebných k vybudování každé z jeho fází v libovolném množství. Pokud analyzujeme systém, jehož složky mohou vzájemně reagovat, vypočítáme hodnotu n odečtením počtu nezávislých reakčních rovnic od celkového počtu složek, které tvoří systém. Pokud tedy předpokládáme následující zápis: ![]() počet nezávislých rovnic je 1 – zkoumáme konkrétní reakci, která v systému probíhá. Nezávislá rovnice je jakýkoli systém chemických rovnic, ve kterém není možné získat žádnou z nich kombinací ostatních. Zatímco počet složek pro takový systém je 3 : jsou to CaC03 , CaO a CO2. Tato informace nám také umožňuje vypočítat počet nezávislých složek: n = počet složek – počet nezávislých rovnic, a tedy: n = 3 – 1 = 2 Stejný příklad můžeme použít pro výpočet počtu stupňů volnosti. pomocí rovnice pro Gibbsovo fázové pravidlo: s = n – f + 2 = 2 – 3 + 2 = 1 Tato hodnota udává, že pro udržení stabilního množství fází v rovnováze systému můžeme provozovat pouze jednu intenzivní proměnnou.
počet nezávislých rovnic je 1 – zkoumáme konkrétní reakci, která v systému probíhá. Nezávislá rovnice je jakýkoli systém chemických rovnic, ve kterém není možné získat žádnou z nich kombinací ostatních. Zatímco počet složek pro takový systém je 3 : jsou to CaC03 , CaO a CO2. Tato informace nám také umožňuje vypočítat počet nezávislých složek: n = počet složek – počet nezávislých rovnic, a tedy: n = 3 – 1 = 2 Stejný příklad můžeme použít pro výpočet počtu stupňů volnosti. pomocí rovnice pro Gibbsovo fázové pravidlo: s = n – f + 2 = 2 – 3 + 2 = 1 Tato hodnota udává, že pro udržení stabilního množství fází v rovnováze systému můžeme provozovat pouze jednu intenzivní proměnnou. 
Heterogenní systémy
Každý systém, který zahrnuje více než jednu fázi (tedy nehomogenní systém), je také heterogenní. Typ fází je irelevantní; heterogenní systém může současně obsahovat několik pevných a kapalných fází, ale pouze jednu plynnou fázi. To je způsobeno tím, že se plyny dokonale mísí. Zajímavým příkladem heterogenního systému je žula – obsahuje mnoho pevných fází, včetně křemene, draselného živce, plagioklasu a biotitu. Mnoho potravinářských produktů lze také nazvat heterogenními, dokonalými příklady jsou vícesložkové müsli nebo salátové omáčky, které se skládají z tuku, koření a dalších přísad. Zajímavým typem nehomogenních směsí jsou koloidy (roztoky, jejichž složky lze rozlišit pouze mikroskopem). Ve většině případů je však lze oddělit jednoduchými metodami nebo nástroji. Například k oddělení směsi složené z vody a oleje můžeme použít dekantaci – složky budou viditelné pouhým okem. Mezi další metody, které můžeme použít k efektivní separaci nehomogenních směsí, patří: filtrace, mechanická segregace nebo centrifugace. Podobné je to u směsi minerálů, které se liší vlastnostmi: křemen, slída a živec lze oddělit i kladivem.
Homogenní systémy
Na rozdíl od heterogenních systémů je homogenní systém charakterizován přítomností pouze jedné fáze. V takovém případě nemůžeme jednotlivé složky pouhým okem rozlišit. Jednoduché metody separace jsou také neúčinné a jako užitečné se mohou ukázat pouze metody založené na fyzikálních vlastnostech. Příkladem takové metody je separace destilací, která je založena na diverzifikovaných bodech varu specifického systému. Dalšími metodami účinnými při separaci homogenních směsí jsou krystalizace a chromatografie. Zvláštním typem homogenního systému je čistá látka, jejíž jediná fáze obsahuje pouze jednu složku. Dalším příkladem jsou všechny typy homogenních roztoků a směsí – i přes přítomnost pouze jedné fáze může systém obsahovat mnoho komponent. Protože fáze přítomná v systému může být kapalina, pevná látka nebo plyn, roztoky mohou mít také takové formy. Příklady takových systémů jsou kapalné směsi (ocet, voda), plynné směsi (atmosférický vzduch) a pevné směsi, včetně minerálních rud a všech typů slitin, jako je bronz nebo mosaz.
Přechody v systémech
V systémech se mohou vyskytovat dva typy přechodů, kterými jsou fázové (někdy nazývané fyzikální) a chemické přechody. První zahrnují všechny přechody, které neprodukují nové chemické látky. Také se nevyznačují vyblednutím již přítomných složek. Jak však název napovídá, vedou k takovým změnám ve struktuře nebo fyzickém stavu. Je také možné, že se vytvoří nová fáze, zatímco původní fáze odezní. Příklady fázových přechodů zahrnují resublimaci a polymorfní přechody prvků. Chemické přechody vykazují zcela jiný mechanismus. Jedná se o reakce, při kterých vznikají nové látky, které nahrazují původní složky. Tyto přechody mohou být prováděny ve dvou variantách, například během hydrolýzy v jedné nebo více fázích a také během hoření.
Chemické reakce
- Homogenní reakce nastávají, když je celý systém včetně substrátů a produktů v jedné fázi, například:
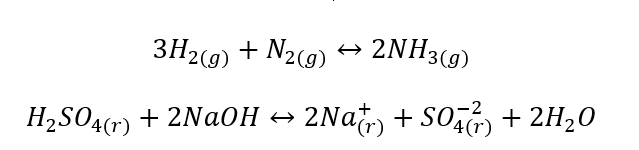
- Heterogenní reakce jsou takové reakce, kdy systém, včetně substrátů a produktů, je alespoň ve dvou různých fázích. Takové reakce se vždy vyskytují na rozhraní, například: