V chemii tvoří některé chemické sloučeniny speciální vazby s molekulami vody. Nejedná se o chemické vazby, ale o interakce krátkého dosahu, které specificky určují vlastnosti těchto sloučenin. Mluvíme o hydrátech. Jejich vlastnosti jsou snadno využitelné ve vybraných průmyslových odvětvích. Nejoblíbenější hydratovanou solí je bezesporu sádra neboli dihydrát síranu vápenatého (VI), který je důležitou surovinou ve stavebnictví. Hydráty jsou také velmi dobrými indikátory obsahu vlhkosti. To souvisí se skutečností, že barva bezvodé soli je často odlišná od barvy hydratované soli.

Hydratuje
Hydráty nejsou chemické sloučeniny, ve kterých dochází k chemickým vazbám , jako jsou kovalentní vazby , mezi molekulami vody a molekulami dané soli . Nejsou také koordinačními sloučeninami. Pro tyto struktury je charakteristické vytváření vodíkových vazeb, které jsou mnohem slabší než chemické vazby. Hydráty jsou strukturovány ve formě krystalové mřížky. Molekuly vody jsou v ní rozmístěny nepravidelně. Často se používá termín „krystalizační voda“. Hydráty se získávají hydratací . S největší pravděpodobností této reakci podléhají molekuly solí, zejména deriváty anorganických kyselin. Hydratace zahrnuje přeměnu bezvodých krystalů na hydratované. Může způsobit změnu minerální hmoty, ale nezničí ji. Hydratace často doprovází další procesy, jako je karbonizace. Hydratační chemikálie se za normálních podmínek vyznačují vysokou hygroskopicitou , tj. silnou afinitou k molekulám vody. Takové látky jsou schopné například absorbovat vlhkost ze vzduchu . Dalším způsobem, jak získat hydráty, je jejich krystalizace z vodných roztoků. Molekulární vzorce hydrátů se tvoří zapsáním vzorce soli a uvedením počtu molekul hydratované vody. Za účelem poskytnutí obecného zápisu je písmeno „n“ umístěno před „H 2 O“. Jeho hodnoty jsou větší než jedna a odpovídá počtu navázaných molekul vody. Nejběžnější rozdíly jsou mezi hydráty s n=½ (hemihydrát), n=1 (monohydrát), n=2 (dihydrát) a n=3 (trihydrát). Důležité je, že stejná látka může připojit různý počet molekul vody. ![]()
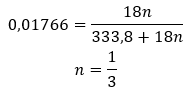 Vzhledem k tomu, že mezi molekulami soli a molekulami vody jsou vodíkové vazby , nevykazují tyto sloučeniny uspokojivou odolnost vůči zvýšeným teplotám. Při zahřívání se rozpadají a mění se na bezvodé formy. Hydráty se velmi dobře rozpouštějí ve vodě. Ve vodných roztocích se uvolňují hydratované molekuly vody navázané na sůl. Tuto skutečnost je třeba vzít v úvahu například při výrobě roztoků těchto látek. Nezohlednění stupně hydratace dané sloučeniny má za následek chyby, byť jen při stanovení koncentrace roztoku. Důležitou charakteristikou hydratovaných solí je změna jejich barvy v důsledku připojení molekul vody v hydratační reakci. Je třeba poznamenat, že hydratované formy vykazují výrazně nižší hygroskopičnost ve srovnání s bezvodými solemi.
Vzhledem k tomu, že mezi molekulami soli a molekulami vody jsou vodíkové vazby , nevykazují tyto sloučeniny uspokojivou odolnost vůči zvýšeným teplotám. Při zahřívání se rozpadají a mění se na bezvodé formy. Hydráty se velmi dobře rozpouštějí ve vodě. Ve vodných roztocích se uvolňují hydratované molekuly vody navázané na sůl. Tuto skutečnost je třeba vzít v úvahu například při výrobě roztoků těchto látek. Nezohlednění stupně hydratace dané sloučeniny má za následek chyby, byť jen při stanovení koncentrace roztoku. Důležitou charakteristikou hydratovaných solí je změna jejich barvy v důsledku připojení molekul vody v hydratační reakci. Je třeba poznamenat, že hydratované formy vykazují výrazně nižší hygroskopičnost ve srovnání s bezvodými solemi.
Hydráty anorganických sloučenin
Soli anorganických kyselin jsou látky, které s největší pravděpodobností tvoří s molekulami vody hydráty. Mezi nejběžnější hydráty anorganických sloučenin patří:
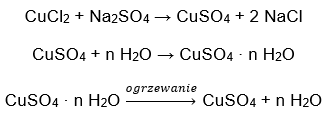
- Hydrát síranu měďnatého (VI), CuSO 4 – síran měďnatý (VI) přijímá různé stupně hydratace. Maximální počet připojených molekul vody je pět. Následkem zahřívání pentahydrátu této soli dochází k odstranění molekul vody. Vzniknou první dva a trihydrát a dalším zahříváním systému lze získat monohydrát síranu měďnatého (VI). Pro odstranění poslední molekuly vody je nutné zahřát sloučeninu na teplotu vyšší než 200 ᵒC. Hydráty síranu měďnatého (VI) mají modrou barvu, což je způsobeno přítomností krystalizační vody kolem iontů mědi. Zatímco bezvodá sůl má bílou barvu. Jeho vysoká hygroskopičnost a schopnost tvořit hydráty se využívá k odstranění vlhkosti z některých kapalin.
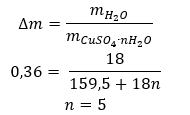
- Hydrát chloridu kobaltnatého, CoCl 2 – bezvodý chlorid kobaltnatý je vysoce hygroskopický. Díky své silné afinitě k molekulám vody je schopen absorbovat vlhkost i ze vzduchu. Tento proces má za následek tvorbu hydrátů této soli. Nejběžnější hydratovanou formou je hexahydrát chloridu kobaltnatého – CoCl 2 * 6H 2 Další formou je molekula dihydrátu. Tato sůl také vykazuje schopnost měnit barvu v závislosti na obsahu vlhkosti. Bezvodá sůl je modrá, dihydrát má růžovofialovou barvu a barva molekuly hexahydrátu je intenzivně červená.
- Hydrát síranu sodného (VI), Na 2 SO 4 – tato sůl existuje ve formě dvou hydrátů: heptahydrátu (pět molekul vody ve struktuře) a dekahydrátu (deset molekul vody ve struktuře). Bezvodá forma síranu sodného (VI) se v přírodě vyskytuje jako vzácný minerál thénardit. Desetihydrát síranu sodného (VI) je tzv. Glauberova sůl. Je široce používán při výrobě skla, papíru, pracích prostředků a sody. Glauberova sůl je také jednou ze složek nezbytných pro výrobu modrého pigmentu ultramarínu. Kromě toho má sloučenina terapeutický účinek na trávicí systém díky svým laxativním vlastnostem.

Sádra
Příkladem hydrátu anorganické soli globálního významu a širokého použití je sádra. Je to minerál tvořený hydratovanou formou síranu vápenatého (VI), CaSO 4 . Krystalický sádrovec je dihydrátem této soli. V přirozených podmínkách vzniká při odpařování slané vody z jezer a řek, při teplotách pod 42ᵒC. Bezvodý síran vápenatý (VI) je anhydrit. Označuje se také jako bezvodá sádra. Stavební sádrovec je naproti tomu hemihydrát síranu vápenatého (VI). Jaká forma této soli se získá, závisí na teplotě převládající při zpracování mateřské sedimentární horniny. Sádra používaná ve stavebnictví je obvykle směsí různých forem hydratované vápenné soli. 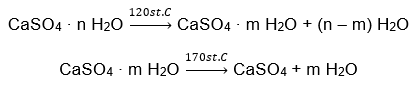
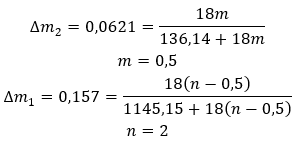 Možnosti použití sádry jsou velmi široké, zejména ve stavebnictví. Nejdůležitější použití tohoto hydrátu soli jsou uvedena níže:
Možnosti použití sádry jsou velmi široké, zejména ve stavebnictví. Nejdůležitější použití tohoto hydrátu soli jsou uvedena níže:
- Ve stavebnictví se sádra používá v dokončovacích prvcích. Je jednou ze složek sypkých polotovarů, malt, lepidel, sádrových apretur a hotových montážních prvků, např. sádrokartonu.
- Medicína používá sádru k zpevnění zlomených končetin. Sádrové obvazy jsou považovány za šetrné k pokožce. Kromě toho se materiál používá také v laboratořích zubní techniky.
- Průmysl používá sádru v modelářských a designérských dílnách. Sádrové odlitky jsou velmi vhodné pro tvarování různých užitných předmětů.
- Sádra je přísada do některých hnojiv používaných v zemědělství.

Klatráty metanu
Metanové klatráty patří do skupiny sloučenin známých jako plynové hydráty. Jsou zodpovědní za většinu rychlých klimatických změn v historii Země. Metanové klatráty jsou také často označovány jako hydráty metanu nebo metanový led. Tvoří pevnou formu vody a metanu . Jejich molekuly se vyznačují krystalickou strukturou. Vznikají pod zvýšeným tlakem. Mají podobu bílých pevných látek bez zápachu, které jsou svým vnějším vzhledem často podobné ledu. Zajímavé je, že na dotek připomínají polystyren . Klatráty jsou jedinečná chemická seskupení . Molekuly vody tvoří strukturu, která připomíná klec. Uvnitř této klece je uložen metan. Důležité je, že tyto dvě látky mezi sebou netvoří chemické vazby. Klatráty metanu se obvykle skládají ze 46 molekul vody obklopujících dvě malé a šest středně velkých klecí. Molekuly metanu jsou v nich zachyceny. Je také známo, že klatráty jsou tvořeny 136 molekulami vody s 16 malými a osmi velkými klecemi plynného metanu uvnitř. V posledních letech bylo na dně oceánů objeveno značné množství tohoto zdroje. Vzbuzuje velký zájem kvůli potenciálu těžit značné množství metanu, který lze využít například pro energetické účely. Metanové klatráty hoří rovnoměrným plamenem, mají načervenalou barvu. Po spálení zůstane roztavená voda. Metan extrahovaný tímto způsobem může být dobrou alternativou ke konvenčním zdrojům uhlovodíků , ale je také značnou hrozbou pro klima. Stále není dostatek znalostí o využívání metanu z klatrátů nahromaděných na dně oceánu. Nekontrolované uvolňování značného množství tohoto plynu může být velmi nebezpečné, protože zesiluje skleníkový efekt mnohem silněji než oxid uhličitý.
