Při pohledu na jejich strukturu jsou karboxylové kyseliny důležitými organickými sloučeninami a jsou to acylové deriváty. Jsou druhem stavebních materiálů pro mnoho derivátů, včetně esterů a amidů. V přírodě se můžeme setkat s celou řadou různých karboxylových kyselin, jako je kyselina octová CH 3 COOH, což je základní sloučenina stolního octa, kyselina máselná CH 3 CH 2 CH 2 COOH zodpovědná za vůni žluklého másla, či více komplexní kyselina cholová, která je základní složkou lidských žlučových šťáv.

Obecný vzorec karboxylových kyselin je:
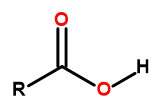
Obrázek 1 Obecný vzorec karboxylových kyselin je:
Názvosloví karboxylových kyselin
Podle nomenklaturního systému IUPAC mohou být karboxylové kyseliny pojmenovány dvěma způsoby, v závislosti na velikosti a složitosti molekuly. Kyseliny, které jsou alifatickými deriváty, jsou pojmenovány systematicky změnou alkanové koncovky z -ane na -oovou a přidáním počátečního slova „kyselina“, například kyselina propanová, kyselina máselná, kyselina 3-ethyl-6-methyloktandiová. Číslování atomů uhlíku v takových chemických sloučeninách vždy začíná atomem ve funkční skupině –COOH. Druhý systém pojmenování, zvláště užitečný pro kyseliny, ve kterých je karboxylová skupina připojena ke kruhu, je povoleno přidat k systematickému názvu sloučeniny slova „kyselina“ před a „karboxylová“ za ním. V takových případech číslování atomů uhlíku začíná atomem, ke kterému je připojena karboxylová skupina, která je sama o sobě považována za substituent.
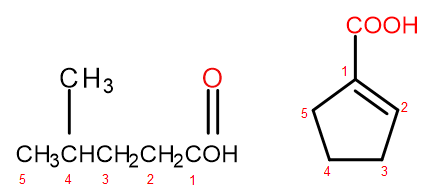
Obrázek 2 Číslování atomů uhlíku v, zleva doprava: kyselina 4-methylpentanová, kyselina 1-cyklopentenkarboxylová.
| Karboxylová kyselina | Acylová skupina | ||
| Struktura | název | Struktura | název |
| HCOOH | Formický | HCO- | Formyl- |
| CH3COOH | octová | CH 3 CO- | Acetyl- |
| CH 3 CH 2 CH 2 COOH | Butyric | CH 3 CH 2 CH 2 CO- | Butyryl- |
| HOOOCCOOH | Šťavelový | -OCCO- | Oxalil- |
| HOOC( CH2 ) 2COOH | Succinic | -OC( CH2 ) 2CO- | sukcinyl- |
Struktura a fyzikální vlastnosti karboxylových kyselin
Podobnost karboxylové skupiny jak ketonům, tak alkoholům může naznačovat podobné fyzikální vlastnosti. Stejně jako v ketonech má atom uhlíku funkční skupiny sp2 hybridizaci. To přímo souvisí s jeho plochou strukturou a úhly asi 120 o mezi vazbami CCO a OCO. Například kyselina octová CH3COOH má vazebné úhly rovné:
- 119 o pro CC=O,
- 119 o pro CC-OH,
- 122 o pro O=C-OH.
Délky vazeb jsou následující:
- 52Å pro CC,
- 25Å pro C=O,
- 31 Á pro C-OH.
Karboxylové kyseliny vykazují svou podobnost s alkoholy díky své silné asociativitě způsobené možností tvorby vodíkových vazeb. V praxi většina těchto sloučenin existuje jako cyklické dimery, jejichž struktura je udržována tvorbou vodíkových vazeb. Takový specifický systém vodíkových vazeb ovlivňuje i teploty varu karboxylových kyselin. Způsobuje jejich výrazné zvýšení oproti odpovídajícím alkoholům. Například fyzikální konstanty – bod tání a bod varu ve stupních Celsia jsou:
- kyselina mravenčí : 8,4; 100,7,
- kyselina octová: 16,6; 117,9,
- Kyselina propanová: -20,8; 141,
- kyselina benzoová: 122,1; 249.
Disociace karboxylových kyselin
Kyselé vlastnosti této skupiny sloučenin jim umožňují reagovat se zásadami, včetně hydroxidu sodného a hydrogenuhličitanu draselného. Produkty takových reakcí jsou soli karboxylových kyselin. Rozpustnost karboxylových kyselin ve vodě je zanedbatelná, ale jejich soli s alkalickými kovy se díky své iontové struktuře ve vodě velmi dobře rozpouštějí. Tyto sloučeniny, které jsou podle Bronsted-Lowryho teorie kyselinami, disociují ve zředěných vodných roztocích. V důsledku přeměny vzniká karboxylátový anion RCOO – a hydroniový kationt H 3 O + .
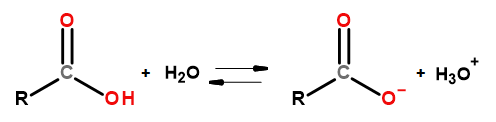
Obrázek 3Schéma disociace karboxylové kyseliny.
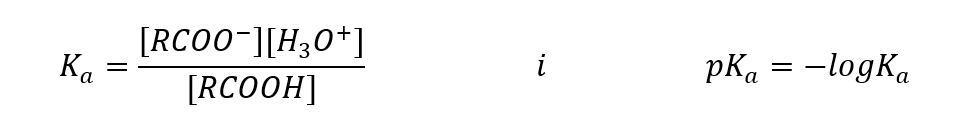 Empiricky stanovené hodnoty pro karboxylové kyseliny ukazují, že se jedná o slabě disociované sloučeniny, v praxi se tedy jedná i o slabé kyseliny. Pro většinu z nich má konstanta K a hodnotu asi 10 -5 . Pro kyselinu octovou je Ka = 1,76· 10-5 , což po konverzi dává pKa hodnotu rovnou 4,75. To se rovná disociaci pouze asi 0,1 %molekul, což ve srovnání se silnými anorganickými kyselinami se stupněm disociace 100 %potvrzuje, že se jedná o kyseliny s nízkou pevností. Ve srovnání s alkoholy, jejichž rovnovážné konstanty oscilují v řádu 10 -16 , jsou karboxylové kyseliny mnohem silnější. Přes jejich strukturní podobnost je tato skutečnost způsobena stabilitou karboxylátového aniontu vzhledem k alkoxidovému aniontu. Všimněte si, že záporný náboj v alkoxidech je na jediném atomu kyslíku, který je vysoce elektronegativní. Naproti tomu v karboxylátových aniontech je náboj delokalizován mezi dva kyslíky funkční skupiny. Díky tomu je stabilnější ve srovnání s aniontem produkovaným alkoholy.
Empiricky stanovené hodnoty pro karboxylové kyseliny ukazují, že se jedná o slabě disociované sloučeniny, v praxi se tedy jedná i o slabé kyseliny. Pro většinu z nich má konstanta K a hodnotu asi 10 -5 . Pro kyselinu octovou je Ka = 1,76· 10-5 , což po konverzi dává pKa hodnotu rovnou 4,75. To se rovná disociaci pouze asi 0,1 %molekul, což ve srovnání se silnými anorganickými kyselinami se stupněm disociace 100 %potvrzuje, že se jedná o kyseliny s nízkou pevností. Ve srovnání s alkoholy, jejichž rovnovážné konstanty oscilují v řádu 10 -16 , jsou karboxylové kyseliny mnohem silnější. Přes jejich strukturní podobnost je tato skutečnost způsobena stabilitou karboxylátového aniontu vzhledem k alkoxidovému aniontu. Všimněte si, že záporný náboj v alkoxidech je na jediném atomu kyslíku, který je vysoce elektronegativní. Naproti tomu v karboxylátových aniontech je náboj delokalizován mezi dva kyslíky funkční skupiny. Díky tomu je stabilnější ve srovnání s aniontem produkovaným alkoholy.
Získávání karboxylových kyselin
- Oxidace substituovaných alkylbenzenů KMnO 4 nebo Na 2 Cr 2 O 7 s produktem ve formě substituovaných benzoových kyselin. Je možné oxidovat primární a sekundární alkylové skupiny,
- Oxidace vazby C=C v alkenech s alespoň jedním vinylovým atomem vodíku pomocí KMnO 4 ,
- Oxidace primárních alkoholů a aldehydů. Alkoholy používající Jonesovo činidlo, aldehydy používající stejné činidlo a zásaditý oxid stříbrný,
- Hydrolýza nitrilů působením silných horkých roztoků kyselin nebo zásad,
- Reakce Grignardových sloučenin s oxidem uhličitým, s meziproduktem ve formě karboxylátu hořečnatého. Přechodná sloučenina poté reaguje s kyselinou.
Reakce karboxylových kyselin
Karboxylové kyseliny díky své struktuře procházejí kromě charakteristických reakcí také přeměnami podobnými alkoholům a ketonům. Stejně jako alkoholy mohou disociovat proton za vzniku nukleofilního činidla. Stejně jako ketony jsou vystaveny útokům jiných nukleofilů na atom uhlíku karbonylové skupiny. Dále je možná jejich redukce, substituce v poloze alfa, nukleofilní substituce acylové skupiny a deprotonace (disociace). Redukce karboxylových kyselin probíhá pomocí LiAlH4 , čímž se získá produkt jako primární alkohol. Někdy je pro zvýšení účinnosti nutné použít zahřívání v tetrahydrofuranovém roztoku. Další metodou je redukce za použití boranu v roztoku tetrahydrofuranu, rovněž za získání 10 alkoholů .
