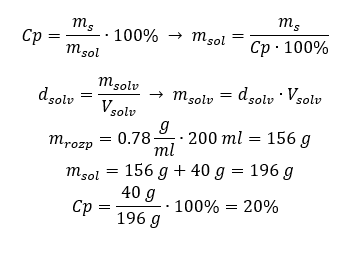V chemii často používáme pojmy jako „koncentrovaný roztok“, „zředěný roztok“ nebo „nasycený roztok“, ale dávají nám jen základní obrys, zda roztok obsahuje velké nebo malé množství konkrétní látky. Existuje však několik metod, které nám pomáhají přesně určit kvantitativní složení daného roztoku. O jednom z nich pojednává následující článek.

Definice procentuální koncentrace
Termín „koncentrace“ označuje míru množství dané látky obsažené v konkrétním roztoku . Koncentraci lze vyjádřit v jednotkách na základě měřítek, které používáme, například v molech, gramech nebo v procentech. Procentuální koncentrace udává, kolik hmotnostních dílů rozpuštěné látky je zahrnuto ve 100 hmotnostních dílech roztoku. Jinými slovy je to počet gramů rozpuštěné látky ve 100 g roztoku. Kupujeme-li například mléko s označením 3,2 %, znamená to, že 100 g mléka obsahuje 3,2 g tuku. Procentuální koncentrace je zkrácena jako Cp.
Obecný vzorec procentuální koncentrace
Pro odvození vzorce pro procentuální koncentraci je třeba mít na paměti, že hmotnost roztoku (m sol ) obsahuje nejen hmotnost rozpouštědla (m solv ), ale také hmotnost rozpuštěné látky (m s ) : m sol = m solv + m s Vezmeme-li například 4%roztok o hmotnosti 100 g, víme, že Cp = 4 %, takže hmotnost látky je 4 g. Definice procentuální koncentrace udává, že pokud je hmotnost roztoku 100 g, pak hmotnost rozpouštědla je 96 g. Procentní koncentraci lze vypočítat podle následujícího vzorce: Cp = (m s /m sol ) · 100 %Jak můžeme vidět ze vzorce, známe-li hmotnost roztoku a hmotnost látky, můžeme snadno vypočítat procentuální koncentrace. Pokud například víme, že roztok váží 450 g a rozpuštěná látka váží 15 g, pak dosazením těchto čísel do vzorce získáme následující: Cp = (15/450) · 100 %= 3,3 %
Výpočet hmotnosti jednotlivých složek v roztoku
Každý vzorec, včetně vzorce pro procentuální koncentraci, lze přeskupit. Pokud známe hmotnost a procentuální koncentraci roztoku, můžeme vypočítat hmotnost rozpuštěné látky. Podobně, pokud známe procentuální koncentraci a hmotnost látky, můžeme vypočítat hmotnost roztoku. Kromě přeskupení vzorce můžeme použít i vhodné proporce. Příklad 1. Kolik gramů cukru potřebujeme na přípravu 300 g 10%roztoku? Z návodu víme, že hmotnost roztoku je 300 g a jeho procentuální koncentrace je 10 %. Hmotnost rozpuštěné látky lze určit dvěma způsoby. Metoda 1. Přeuspořádání vzorce 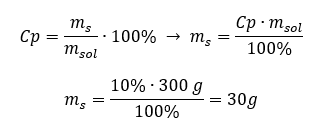 Metoda 2. Pomocí poměrů s vědomím, že 10%roztok obsahuje 10 g cukru ve 100 g roztoku:
Metoda 2. Pomocí poměrů s vědomím, že 10%roztok obsahuje 10 g cukru ve 100 g roztoku: 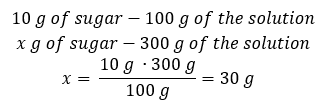 Oba způsoby nás dovedou k závěru, že na přípravu 300 g 10%roztoku bude potřeba 30 g cukru.
Oba způsoby nás dovedou k závěru, že na přípravu 300 g 10%roztoku bude potřeba 30 g cukru.  Příklad 2. V kolika gramech vody musíme rozpustit 10 g látky, abychom získali 50%roztok? Z návodu víme, že hmotnost látky je 10 g a procentuální koncentrace roztoku je 50 %. To znamená, že 100 g roztoku obsahuje 50 g látky. Hmotnost roztoku lze určit dvěma způsoby. Vezměte prosím na vědomí, že hmotnost roztoku se nerovná hmotnosti rozpouštědla. Abychom vypočítali hmotnost rozpouštědla, musíme odečíst hmotnost látky od hmotnosti roztoku. Metoda 1. Přeuspořádání vzorce
Příklad 2. V kolika gramech vody musíme rozpustit 10 g látky, abychom získali 50%roztok? Z návodu víme, že hmotnost látky je 10 g a procentuální koncentrace roztoku je 50 %. To znamená, že 100 g roztoku obsahuje 50 g látky. Hmotnost roztoku lze určit dvěma způsoby. Vezměte prosím na vědomí, že hmotnost roztoku se nerovná hmotnosti rozpouštědla. Abychom vypočítali hmotnost rozpouštědla, musíme odečíst hmotnost látky od hmotnosti roztoku. Metoda 1. Přeuspořádání vzorce 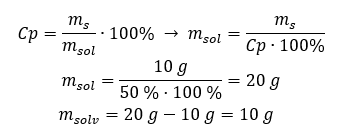 Metoda 2. Použije se poměry s vědomím, že 100 g roztoku obsahuje 50 g látky.
Metoda 2. Použije se poměry s vědomím, že 100 g roztoku obsahuje 50 g látky. 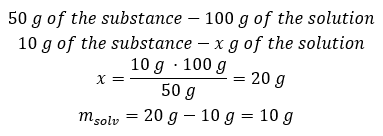 Bez ohledu na metodu, kterou použijeme, odpověď bude, že abychom získali 50%roztok, musíme rozpustit 10 g látky v 10 g vody.
Bez ohledu na metodu, kterou použijeme, odpověď bude, že abychom získali 50%roztok, musíme rozpustit 10 g látky v 10 g vody.
Příprava řešení
Klíčovým prvkem práce v laboratoři je znalost přípravy roztoků s konkrétními koncentracemi. Za tímto účelem musíme znát hmotnost jeho složek. Dříve vypočítaná hmotnost látky by měla být rozpuštěna v přesně změřeném objemu rozpouštědla. Potřebný objem lze vypočítat, pokud známe hmotnost a hustotu kapaliny. Hustota roztoku je fyzikální hodnota specifická pro každou kapalinu, která definuje hmotnost roztoku na jednotku objemu. Tato hodnota úzce souvisí s teplotou. Pokud víme, že hustota roztoku je 2,03 g/ml, pak víme také, že 1 ml roztoku váží 2,03 g. Obvykle používáme následující jednotky hustoty: g/ml = g/cm 3 , g/l = g/dm 3 , ale existují i jiné, např. kg/m 3 . Hustota roztoku se vypočítá podle následujícího vzorce: d sol = m sol /v sol , kde m sol je hmotnost roztoku a V sol je jeho hustota. Pokud známe objem a hustotu roztoku, můžeme vypočítat jeho hmotnost. Příklad 3. Jakou hmotnost má 20 ml roztoku o hustotě 1,201 g/ml? Metoda 1. Přeuspořádání vzorce 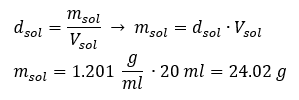 Metoda 2. Pomocí poměrů s vědomím, že 1,201 g roztoku má objem 1 ml
Metoda 2. Pomocí poměrů s vědomím, že 1,201 g roztoku má objem 1 ml 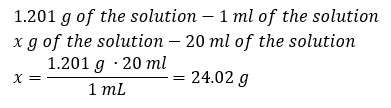 Obě metody ukázaly, že roztok o hustotě 1,201 g/ml a objemu 20 ml má hmotnost 24,02 g. Pokud známe hustotu, můžeme provést ještě více výpočtů v kontextu procentuální koncentrace. Příklad 4. Kolik gramů soli obsahuje 10 ml 15%roztoku, je-li jeho hustota 1,035 g/ml? Metoda 1. Přeuspořádání vzorců
Obě metody ukázaly, že roztok o hustotě 1,201 g/ml a objemu 20 ml má hmotnost 24,02 g. Pokud známe hustotu, můžeme provést ještě více výpočtů v kontextu procentuální koncentrace. Příklad 4. Kolik gramů soli obsahuje 10 ml 15%roztoku, je-li jeho hustota 1,035 g/ml? Metoda 1. Přeuspořádání vzorců 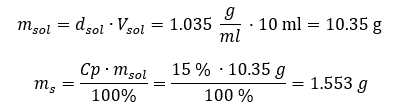 Metoda 2. Použití proporcí
Metoda 2. Použití proporcí 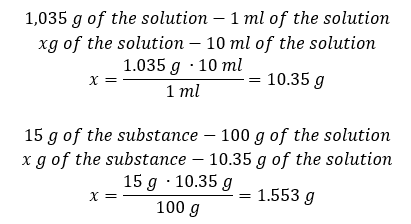 Obě metody ukázaly, že k přípravě 10 ml roztoku s Cp = 15 %a hustotou 1,035 g/ml musíme navážit 1,553 g soli. Příklad 5. Jaká je procentuální koncentrace roztoku vzniklého rozpuštěním 40 g látky ve 200 ml ethanolu o hustotě 0,78 g/ml? Pro výpočet můžeme použít vzorec pro procentuální koncentraci. Hmotnost roztoku lze vypočítat sečtením hmotností rozpuštěné látky a rozpouštědla. Hmotnost rozpouštědla není známa, ale známe jeho hustotu a objem, takže chybějící údaje lze vypočítat přeskupením vzorce pro hustotu.
Obě metody ukázaly, že k přípravě 10 ml roztoku s Cp = 15 %a hustotou 1,035 g/ml musíme navážit 1,553 g soli. Příklad 5. Jaká je procentuální koncentrace roztoku vzniklého rozpuštěním 40 g látky ve 200 ml ethanolu o hustotě 0,78 g/ml? Pro výpočet můžeme použít vzorec pro procentuální koncentraci. Hmotnost roztoku lze vypočítat sečtením hmotností rozpuštěné látky a rozpouštědla. Hmotnost rozpouštědla není známa, ale známe jeho hustotu a objem, takže chybějící údaje lze vypočítat přeskupením vzorce pro hustotu.