Spektroskopické metody jsou skupinou metod, při kterých vzniká signál interakcí elektromagnetického nebo korpuskulárního záření se zkoumaným vzorkem. Toto záření může vznikat v důsledku periodických změn elektromagnetického pole spojených s přenosem energie. Tyto metody se používají ke stanovení koncentrace nebo obsahu atomů v daném absorbujícím nebo emitujícím systému. Jaké typy spektrofotometrie existují a co tyto metody zahrnují? To se dozvíte z našeho článku.

Radiační a energetické přechody
Nejdůležitější vlastností fotonů neboli radiačních kvant je energie. Vzorec pro energetickou hodnotu (E) je součinem Planckovy konstanty (h) 6,626·10 -34 [J ·s] a frekvence záření (v) vyjádřené v Hertzech [Hz]. 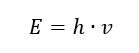 Spektrofotometrie využívá energetické přechody v molekulách způsobené absorpcí nebo emisí elektromagnetického záření v různých rozsazích:
Spektrofotometrie využívá energetické přechody v molekulách způsobené absorpcí nebo emisí elektromagnetického záření v různých rozsazích:
- ultrafialové (UV) 200-380 nm,
- viditelné záření (Vis) 380-780 nm,
- blízké infračervené (IR) 0,78-30000 μm.
Základní pojmy a zákony spektrofotometrie
Isosbestický bod
Toto je bod odpovídající specifické vlnové délce vyplývající z průsečíku křivek vynesených v systému absorbance-vlnová délka, kde obě formy sloučeniny v roztoku (disociovaná a nedisociovaná) mají stejnou absorpci. Změna pH nemění polohu, sloučenina může mít mnoho takových bodů.
Absorpční spektrum chemické sloučeniny
Spektrum je mírou množství světla absorbovaného sloučeninou z vlnové délky světla (λ). Dopadne-li na vzorek elektromagnetické záření (světlo) o intenzitě I 0 , část tohoto záření se pohltí a část projde vzorkem. Zaznamenáním intenzit dopadajícího (I 0 ) a prošlého (I t ) záření můžeme určit množství světla, které je roztokem absorbováno (absorbance, A), nebo které jím prošlo (propustnost, T).
Absorbance
Veličina, která popisuje jev absorpce, je absorbance. Jedná se o bezrozměrnou míru intenzity elektromagnetického záření vzhledem k počtu volných atomů. Tento údaj byl zaveden pro usnadnění výpočtů souvisejících s objemy absorpce. Absorpce je interakce mezi elektromagnetickým zářením a hmotou – absorpce části energie hmotou. Absorbance je aditivní a někdy se nazývá optická hustota. Symbolicky se zaznamenává jako Abs nebo A. Matematicky je to dekadický logaritmus poměru intenzity paprsku záření dopadajícího na zkušební vzorek (I 0 ) k intenzitě paprsku záření procházejícího zkušebním vzorkem. ( To ). Může nabývat hodnot od 0 do nekonečna. Matematický výraz popisující tento vztah se nazývá Beer-Lambertův zákon. Absorbance při dané vlnové délce závisí na absorpčním koeficientu (ε), tloušťce absorbující vrstvy (obvykle 1 cm) a koncentraci testovaného roztoku.
Propustnost
Transmitance je poměr ozáření procházejícího vzorkem (I t ) k ozáření dopadajícím na vzorek (I 0 ), který se rovná ozáření procházejícím referencí. Nejčastěji se vyjadřuje v procentech a může se pohybovat od 0 %do 100 %. Vyjadřuje se vzorcem: 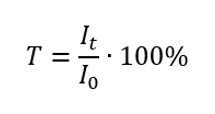 Vztah mezi absorbancí a propustností je vyjádřen takto:
Vztah mezi absorbancí a propustností je vyjádřen takto: 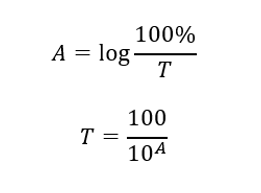
Lambertův zákon
Říká, že absorbance je úměrná tloušťce absorbující vrstvy homogenního vzorku. Může být zaznamenán jako podíl koeficientu absorpce (k) a tloušťky vrstvy měřeného vzorku (l): 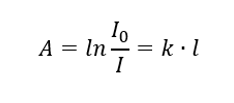

Beer-Lambertův zákon
Týká se absorpce záření roztoky a lze ji formulovat následovně: je-li koeficient absorpce rozpouštědla nulový, pak je absorbance monochromatického svazku záření procházejícího homogenním roztokem přímo úměrná koncentraci (c) roztoku. a na tloušťku absorbující vrstvy (l). Beer-Lambertův zákon je definicí absorbance a lze jej napsat takto: 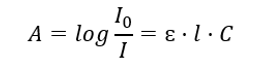 Molární absorpční koeficient (ɛ) je charakteristická hodnota látky v určitém rozpouštědle a při určité vlnové délce. Je úměrná pravděpodobnosti přechodů mezi energetickými hladinami molekuly a přímo závisí na energii fotonů záření. V číselném vyjádření představuje absorbanci, kterou vykazuje roztok o koncentraci 1 mol/dm 3 s tloušťkou absorpční vrstvy 1 cm. Znalost koeficientu umožňuje stanovit koncentraci zkušebního roztoku po změření velikosti absorbance. Volitelně lze také vypočítat očekávanou absorbanci roztoku z koeficientu a koncentrace. Vzorec se používá především ke stanovení koncentrace látky se známým molárním absorpčním koeficientem a empiricky měřenou absorbancí. To lze provést pomocí vzorce nebo nakreslením kalibrační křivky pro látku v několika bodech v rozsahu očekávané koncentrace. Beer-Lambertův zákon lze také prezentovat jako koncentrační závislost absorpce: A = f(C).
Molární absorpční koeficient (ɛ) je charakteristická hodnota látky v určitém rozpouštědle a při určité vlnové délce. Je úměrná pravděpodobnosti přechodů mezi energetickými hladinami molekuly a přímo závisí na energii fotonů záření. V číselném vyjádření představuje absorbanci, kterou vykazuje roztok o koncentraci 1 mol/dm 3 s tloušťkou absorpční vrstvy 1 cm. Znalost koeficientu umožňuje stanovit koncentraci zkušebního roztoku po změření velikosti absorbance. Volitelně lze také vypočítat očekávanou absorbanci roztoku z koeficientu a koncentrace. Vzorec se používá především ke stanovení koncentrace látky se známým molárním absorpčním koeficientem a empiricky měřenou absorbancí. To lze provést pomocí vzorce nebo nakreslením kalibrační křivky pro látku v několika bodech v rozsahu očekávané koncentrace. Beer-Lambertův zákon lze také prezentovat jako koncentrační závislost absorpce: A = f(C).
Zákon aditivity
Beer-Lambertův zákon se týká případu, kdy je v roztoku jedna absorbující látka. Pokud je však ve vícesložkovém roztoku více látek, které absorbují záření o zvolené vlnové délce, je absorbance tohoto roztoku (A) rovna součtu absorbancí jeho jednotlivých složek (A 1 , A 2 ,…), tzn. A=A 1 +A 2 +⋯+A n . Stojí za zmínku a zapamatování, že absorbance každé složky je součinem její koncentrace a odpovídajícího molárního absorpčního koeficientu. Toto je 3. zákon absorpce, používaný ve spektrofotometrické analýze vícesložkových systémů.
Odchylky od zákonů absorpce
Předpokladem pro splnění zákonů absorpce je, aby záření působící na systém bylo monochromatické a aby jeho intenzita nebyla příliš vysoká. Důvody pro odchýlení se od Beer-Lambertova zákona mohou být:
- nedokonalost měřicích přístrojů, která má za následek nesplnění podmínky,
- chemické reakce probíhající během měření, například polymerace , hydrolýza, kondenzace,
- zakalení roztoku.
Aplikace elektronových absorpčních spekter
- Umožňuje určit typ elektronových přechodů zkoumáním spekter v rozpouštědlech různé polarity.
- Rozdíly v poloze a intenzitě absorpčních pásů různých molekulárních forem se používají ke studiu mezi nimi vytvořených rovnováh v roztoku ( strukturní studie , tautomerní rovnováhy).
- Používá se pro stanovení sloučenin na základě Beer-Lamberova zákona.
- Používá se jako doplňková metoda identifikace na základě polohy λ max testovaných látek.
- Používá se při stanovení čistoty testovaných sloučenin – posunutí polohy absorpčního maxima, porovnání poměru hodnot absorbance ve dvou různých bodech spektra.

UV-Vis elektronová spektroskopie
Z hlediska fenoménu absorpce je UV-Vis spektrofotometrie zvláště zajímavou technikou, která umožňuje kvalitativní a kvantitativní analýzu mnoha látek. Fenomén absorpce záření se používá, když: absorpce závisí lineárně na koncentraci nebo je absorpce aditivní, tj. pro vícesložkový roztok je součtem absorpcí jeho složek. Podmínky jsou splněny, když v systému nedochází k intermolekulárním interakcím. Analýzou UV-Vis absorpčních spekter vzniklých při průchodu elektromagnetického záření roztokem jsou pozorovány přechody valenčních elektronů ze základního do excitovaného stavu. Tento jev má za následek absorpci části záření o určitých vlnových délkách. Absorpce je důsledkem přechodu těchto elektronů na vyšší energetické hladiny, ale aby k tomu došlo, musí mít kvanta elektromagnetického záření dostatek energie, aby vyrovnala energetický rozdíl mezi energetickými hladinami. V molekulách jsou takové energie několik elektronvoltů, což přesně odpovídá frekvenci UV-Vis.
Chromofory
Sloučeniny, které vykazují absorpci v oblasti UV-Vis, mají ve své struktuře chromofory, tj. skupiny atomů, jejichž elektrony se vyznačují nízkou excitační energií. Jinými slovy, chromofor je část molekuly (skupina atomů) zodpovědná za selektivní absorpci záření ve viditelné oblasti (180-800 nm) a tím za vznik barvy. Patří sem: aromatické kruhy (aromatický elektronový sextet), násobné vazby (jejich část – vazby typu π), a to jak mezi atomy uhlíku, tak i další, např. karbonylová skupina C=O.
Auxochromy
Další skupinou atomů jsou auxochromy, tedy substituenty, které nevykazují absorpci v oblasti UV-Vis, ale jejich přítomnost způsobuje změny ve spektrech absorbujících prvků. Zesilují působení chromoforů, což můžeme často pozorovat v podobě mnohem intenzivnějšího zbarvení testované látky než v případě jejich nepřítomnosti v systému. Kromě toho dělíme auxochromy na batochromy , např. –NH 2 , -OH, které posouvají absorpční maximum k delším vlnovým délkám, a hypsochromy , jako je –CH 3 , -CO, které posouvají maximum ke kratším vlnovým délkám.
Atomová absorpční spektroskopie (AAS)
Toto je další technika využívající fenomén absorpce. Slouží ke stanovení chemických prvků ve formě vzorků v libovolném skupenství (kapalina, pevná látka, plyn) a samotné měření je založeno na pozorování absorpce záření o konkrétní vlnové délce volnými atomy kovů. Základem techniky je, že atom může pohlcovat pouze elektromagnetické záření o vlnové délce, při které ho může i vyzařovat, a to je charakteristické pouze pro daný prvek. S vyšší energií dodanou atomu jsou elektrony excitovány na vyšší úrovně a ve spektru je pozorován větší počet čar. Pokud dodaná energie odpovídá ionizačnímu potenciálu atomu, tvoří se ionty jako Na + . Základem kvantitativní analýzy atomovou absorpční spektrometrií je úměrnost absorbance k počtu absorbujících atomů a Beer-Lambertův zákon.
























































































































