Alkane gehören in Bezug auf ihre chemische Struktur zur Gruppe der Kohlenwasserstoffe. Das sind Verbindungen, die nur zwei Arten von Atomen enthalten - Kohlenstoff und Wasserstoff. Sie bestehen aus einem Kohlenstoffgrundgerüst und daran gebundenen Wasserstoffatomen. Bei den Alkanen sind alle Bindungen einfach, weshalb sie auch als gesättigte Kohlenwasserstoffe bezeichnet werden.

Homologe Reihe
Die Vertreter der Alkane, geordnet nach der zunehmenden Anzahl der Wasserstoffatome in der Struktur, bilden eine homologe Reihe. Es beginnt mit Methan, das ein Kohlenstoffatom enthält, und endet mit dem zehnkohlenstoffhaltigen Decan. Die Nomenklatur der Alkane ergibt sich aus der Anzahl der in der Struktur vorhandenen Kohlenstoffatome, die durch griechische oder lateinische Ziffern beschrieben werden, und der charakteristischen Endung -an, zum Beispiel Heptan, Nonan usw.
Die allgemeine Formel von Alkanen lautet: , wo „n“ die Anzahl der in der Kette vorhandenen Kohlenstoffatome (C) und „H“ die Wasserstoffatome bezeichnet.
| Anzahl der in der Kette vorhandenen Kohlenstoffatome | Formel des Alkans | Name des Alkans |
| 1 | CH4 | Methan |
| 2 | C2H6 | Ethan |
| 3 | C3H8 | Propan |
| 4 | C4H10 | Butan |
| 5 | C5H12 | Pentan |
| 6 | C6H14 | Hexan |
| 7 | C7H16 | Heptan |
| 8 | C8H18 | Oktan |
| 9 | C9H20 | Nonan |
| 10 | C10H22 | Dekan |
Arten von gesättigten Kohlenwasserstoffen
Aufgrund ihrer Kettenstruktur werden Alkane unterteilt in:
-
Mit unverzweigten Kette (Paraffine)
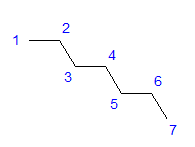
Abb. 1 Strukturformel von Heptan
Alle Kohlenstoffatome weisen eine Hybridisierung sp3 auf. Aufgrund des tetragonalen Winkels zwischen den Bindungen ist eine zickzackförmige Anordnung der Kohlenstoffatome erforderlich. Moleküle können verschiedene Anordnungen einnehmen, da eine freie Rotation um eine Einfachbindung zwischen Kohlenstoffatomen möglich ist. Je höher die Anzahl der Kohlenstoffe in einer gegebenen Struktur ist, desto größer ist die Möglichkeit einer Vielzahl von Kettenformen.
-
Isoalkane, also verzweigte gesättigte Kohlenwasserstoffe
Verzweigte Kohlenwasserstoffe entstehen, wenn sich ein Kohlenstoffatom mit mehr als zwei anderen Kohlenstoffatomen verbindet. An der Stelle, an der eine solche Verbindung stattfindet, bildet sich eine Verzweigung. Verzweigte Kohlenwasserstoffe sind Isomere der unverzweigten Kohlenwasserstoffe.
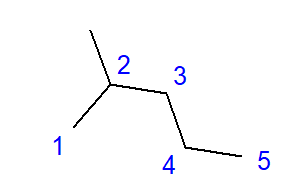
Abb. 2 Strukturformel von 2-Methylpentan
Die in Abbildung 2 dargestellte Formel von 2-Methylpentan besitzt in Summe sechs Kohlenstoffatome und ist ein Isomer von Hexan. Der Name 2-Methylpentan weist darauf hin, dass die Pentankette an der Position des zweiten Kohlenstoffs eine Methylgruppe trägt. Mit zunehmender Zahl der Kohlenstoffatome im Molekül steigt die Zahl der möglichen Konstitutionsisomere. So kann Hexan beispielsweise eine Struktur mit 5 verschiedenen Isomeren aufweisen, Octan hat 18 solcher Möglichkeiten und Decan sogar 75.
-
Aromatische Kohlenwasserstoffe – Cycloalkane, alizyklische Kohlenwasserstoffe
Eine Schließung der Kettenstruktur ist möglich, wobei sich Ringe aus sich wiederholenden -CH2-Elementen bilden. Die Namen werden aus dem Namen des Alkans mit der Vorsilbe Cyclo- gebildet, z.B. Cyclobutan, Cycloheptan. Hilfsweise werden sie als regelmäßige Polygone dargestellt.
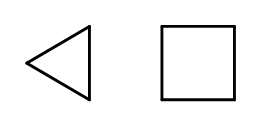
Abb. 3 Von links: Cyclopropan, Cyclobutan
Es gibt auch substituierte Ringe, bei denen die Substituenten benannt sind. In diesem Fall wird die Nummerierung der Kohlenstoffatome so festgelegt, dass die Substituenten die möglich niedrigste Position einnehmen.
Führende Vertreter der Gruppe
Methan ist eine Verbindung mit der Summenformel CH4 und steht am Anfang der homologen Reihe von Alkanen. Der Kohlenstoff ist vierwertig und hat daher vier C-H-Bindungen. Bei Raumtemperatur ist es gasförmig, geruchlos und farblos. Da das Kohlenstoffatom eine Hybridisierung sp3– aufweist, ist seine Struktur tetraedrisch, und die daraus resultierenden Orbitale bilden zusammen mit den vier Wasserstoffatomen gleichwertige Bindungen.
Ethan ist der nächste in der Reihe der Alkane, deren Summenformel C2H6 lautet. Wenn man die Halbstrukturformel H3C-CH3 aufschreibt, erkennt man, dass an jedes Kohlenstoffatom drei Wasserstoffatome gebunden sind. Wie Methan und andere niedere Kohlenwasserstoffe ist es ein farbloses und geruchloses Gas. Die C-H-Bindungen sind vom Typ sigma sp-s face, während die Einfachbindung zwischen den Kohlenstoffatomen eine sigma sp-sp face-Bindung ist.
Synthese von Alkanen
- Hydrierung von Alkenen oder Alkinen

- Hydrolyse von Grignard-Verbindungen
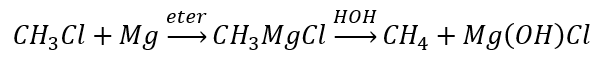
- Reduktion von Alkylhalogeniden
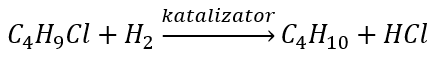
- Wurtzsche Synthese
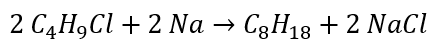
Reduktion von Aldehyden und Ketonen
- Clemmensen-Reduktion
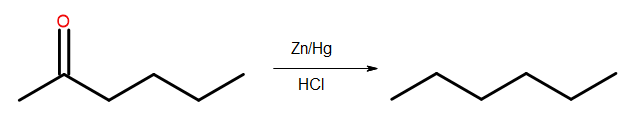
Abb. 4 Schema der Clemmensen-Reduktion
- Wolff-Kishner-Reaktion
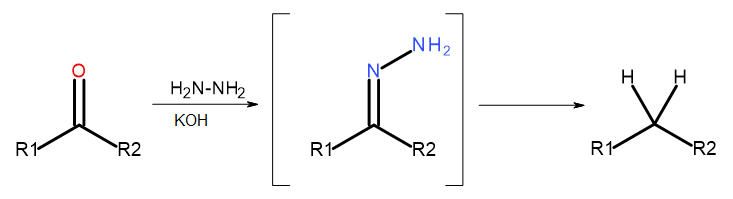
Abb. 5 Schema der Wolff-Kishner-Reaktion
Physikalisch-chemische Eigenschaften von Alkanen
Kurzkettige Alkane von C1 bis C4 sind bei Raumtemperatur Gase. Im Gegensatz dazu sind andere Homologe ab Pentan Flüssigkeiten mit steigenden Siedepunkten. Die in den Strukturen vorhandenen Verzweigungen führen zu niedrigeren Siedepunkten der Isomere. Die Abhängigkeit von der Hinzufügung einer weiteren -CH2-Gruppe in der Struktur und dem Siedepunkt ist etwa 20-30oC höher mit zunehmender Kohlenstoffkettenlänge. Der Aggregatzustand der Alkane ab Oktadecan aufwärts ist ein fester Körper mit Schmelzpunkten ab 28oC für n-Oktadecan. Bei den festen Kohlenwasserstoffen handelt es sich um Paraffin, bei den höheren flüssigen Kohlenwasserstoffen um Paraffinöl.
Die hydrophobe Beschaffenheit von Alkanmolekülen bedeutet, dass sie sich nicht mit Wasser vermischen, von diesem nicht benetzbar sind und sich nicht in Wasser auflösen. Im Gegensatz dazu sind sie aufgrund ihrer Ähnlichkeit mit unpolaren Eigenschaften gut in sich selbst und in ähnlichen unpolaren, mittel- und niederpolaren organischen Lösungsmitteln löslich. Die Löslichkeit von Alkanen in zwei gängigen alkoholischen Lösungsmitteln, nämlich Methanol und Ethanol, ist relativ gut. In Methanol lösen sich Alkane nur bis zu einer bestimmten Konzentration gut. Darüber hinaus kommt es zu einer Phasentrennung. In Ethanol lösen sich die niederen Alkane sehr leicht, während sich die höheren Alkane etwas schlechter lösen.
Alle Kohlenwasserstoffe sind leicht entzündliche Stoffe. Kohlenwasserstoffe, die Gase sind, sowie Dämpfe flüssiger Kohlenwasserstoffe bilden in Verbindung mit Luft ein explosionsfähiges Gemisch.
Die Reaktivität von Alkanen ist aufgrund des Mangels an potenziell reaktiven funktionellen Gruppen relativ gering. Sowohl die Bindungen zwischen Kohlenstoffatomen C-C als auch die zwischen Kohlenstoff- und Wasserstoffatomen C-H sind sehr widerstandsfähig gegen ihre Aufspaltung. Die Energie dieser Bindungen beträgt 88 kcal/mol bzw. 104 kcal/mol. Nur unter bestimmten Bedingungen können sie heftig reagieren.
Reaktionen von Alkanen
- Vollständige Verbrennung – mit Freisetzung von Kohlendioxid
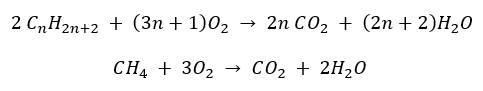
- Halbverbrennung – mit begrenzter Sauerstoffzufuhr und Freisetzung von Kohlenmonoxyd
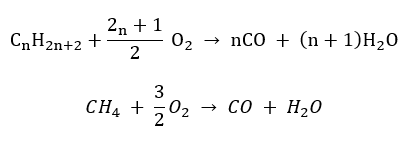
- Unvollständige Verbrennung – bei sehr begrenzter Sauerstoffzufuhr, es entsteht Ruß
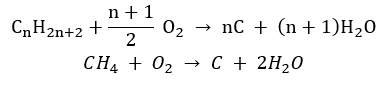
- Substitutionsreaktion (radikalische Halogenierung – am Beispiel der Reaktion von Methan mit Chlor, unter Beteiligung von Licht
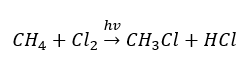
- Pyrolyse, d.h. die Zersetzung von Alkanen in kleinere Moleküle unter Einwirkung sehr hoher Temperaturen. Je nach Verfahren kann es zum Cracking, Hydrocracking oder zur Isomerisierung kommen.
- Nitrierung unter Verwendung von Salpetersäure(V), wobei eine Mischung von Produkten – Isomeren – entsteht, die den Substituenten -NO2 an verschiedenen Stellen aufweisen.
- Zweistufige Sulfonierung mit Mersolen als Zwischenprodukt und Mersolaten als Endprodukt.