Strukturell gesehen sind Carbonsäuren wichtige organische Verbindungen, Acylderivate. Sie sind eine Art Baumaterial für zahlreiche Derivate, darunter Ester und Amide. In der Natur finden wir eine ganze Reihe verschiedener Carbonsäuren, wie z.B. Essigsäure CH3COOH, die Grundverbindung von Tafelessig, Buttersäure CH3CH2CH2COOH, die für den Geruch von ranziger Butter verantwortlich ist, oder die komplexere Cholsäure, die der Grundbestandteil der menschlichen Gallensäfte ist.

Die allgemeine Formel für Carbonsäuren lautet:
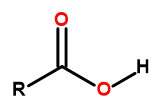
Abbildung1Allgemeine Formel der Carbonsäuren.
Nomenklatur von Carbonsäuren
Nach dem Bezeichnungssystem IUPAC können Carbonsäuren auf zwei Arten benannt werden, je nach Größe und Komplexität des Moleküls. Säuren, die aliphatische Derivate sind, werden systematisch benannt, indem man bei ihnen die Endung „Säure“ hinzufügt, z.B. Propansäure, Butansäure, 3-Ethyl-6-methyloctandisäure. Die Nummerierung der Kohlenstoffatome in solchen chemischen Verbindungen beginnt immer mit dem Atom, das sich in der funktionellen Gruppe -COOH befindet. Ein zweites Nomenklatursystem, das vor allem für Säuren mit einer an den Ring gebundenen Carboxygruppe nützlich ist, wird durch Hinzufügen der Worte „Carbon“ vor und „Säure“ nach der systematischen Bezeichnung zugelassen. In diesen Fällen beginnt die Nummerierung der Kohlenstoffatome mit dem Atom, an das die Carboxygruppe gebunden ist, die selbst als Substituent behandelt wird.
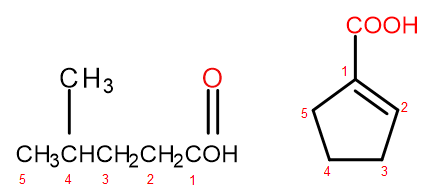
Abbildung 2 Nummerierung der Kohlenstoffatome in, von links: 4-Methylpentansäure, 1-Cyclopentencarbonsäure.
Aufgrund der historischen Gliederung, wonach Carbonsäuren zu den ersten isolierten, gereinigten und charakterisierten organischen Verbindungen gehörten, erlaubt das IUPAC-System auch viele gebräuchliche Namen sowohl für organische Verbindungen als auch für ihre Acylgruppen.
Tabelle 1 Ausgewählte Beispiele für gebräuchliche Namen von Carbonsäuren und ihren Acylgruppen
| Carbonsäure | Acylgruppe | ||
| Struktur | Name | Struktur | Name |
| HCOOH | Ameisensäure | HCO- | Formyl- |
| CH3COOH | Essigsäure | CH3CO- | Acetyl- |
| CH3CH2CH2COOH | Buttersäure | CH3CH2CH2CO- | Butan- |
| HOOOCCOOH | Oxalsäure | -OCCO- | Oxal- |
| HOOC(CH2)2COOH | Bernsteinsäure | -OC(CH2)2CO- | Succinyl- |
Struktur und physikalische Eigenschaften von Carbonsäuren
Die Ähnlichkeit der Carboxylgruppe sowohl mit Ketonen als auch mit Alkoholen könnte auf ähnliche physikalische Eigenschaften hindeuten. Wie bei den Ketonen weist das Kohlenstoffatom der funktionellen Gruppe eine Hybridisierung sp2 auf. Dies steht in direktem Zusammenhang mit seiner flachen Struktur und den Winkeln von etwa 120o zwischen den Bindungen C-C-O und O-C-O. Bei Essigsäure CH3COOH beispielsweise sind die Winkel zwischen den Bindungen gleich:
- 119o für C-C=O,
- 119o für C-C-OH,
- 122o für O=C-OH.
Die Bindungslängen hingegen betragen wie folgt:
- 1,52Å für C-C,
- 1,25Å für C=O,
- 1,31Å für C-OH.
Ihre Ähnlichkeit mit Alkoholen zeigen Carbonsäuren aufgrund ihrer starken Assoziation, die durch die Möglichkeit der Bildung von Wasserstoffbindungen verursacht wird. In der Praxis treten die meisten dieser Verbindungen als zyklische Dimere auf, deren Struktur durch die Bildung von Wasserstoffbrücken aufrechterhalten wird. Diese spezifische Anordnung der Wasserstoffbrückenbindungen beeinflusst auch die Siedepunkte der Carbonsäuren. Sie bewirkt, dass sie im Vergleich zu den entsprechenden Alkoholen deutlich erhöht sind. Zum Beispiel betragen die physikalischen Konstanten – Schmelzpunkt und Siedepunkt in Grad Celsius – jeweils für:
- Ameisensäure: 8,4; 100,7,
- Essigsäure: 16,6; 117,9,
- Propansäure:-20,8; 141,
- Benzoesäure: 122,1; 249.
Dissoziation von Carbonsäuren
Die sauren Eigenschaften dieser Gruppe von Verbindungen ermöglichen die Reaktion mit Basen, darunter Natriumhydroxid und Kaliumbicarbonat. Die Produkte solcher Reaktionen sind Salze von Carbonsäuren. Die Wasserlöslichkeit von Carbonsäuren ist sehr gering, aber ihre Lithiumsalze lösen sich aufgrund ihrer ionischen Struktur sehr gut in Wasser. Diese Verbindungen, die laut Definition nach Brønsted und Lowry Säuren sind, dissoziieren in verdünnten wässrigen Lösungen. Als Ergebnis der Umwandlung entstehen das Carboxylat-Anion RCOO– und das Hydronium-Kation H3O+.
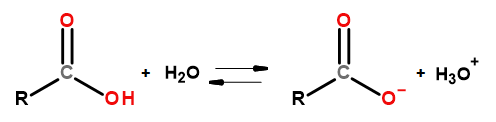
Abbildung 3 Schematische Darstellung der Dissoziation einer Carbonsäure.
In Analogie zu anderen Säuren kann man die Säurekonstante (Ka) und ihren Logarithmus aufschlüsseln:
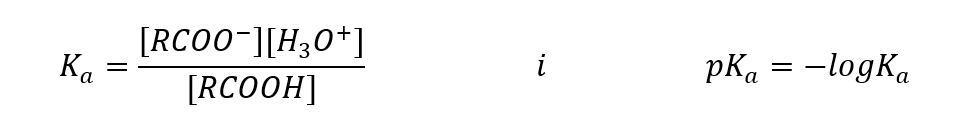
Empirisch ermittelte Werte für die Carbonsäuren zeigen, dass es sich um schwach dissoziierte Verbindungen handelt, so dass sie in der Praxis auch als schwache Säuren gelten. Für die meisten von ihnen beträgt die Ka-Konstante ca. 10-5. Für Essigsäure
beträgt Ka = 1,76-10-5, was nach Umrechnung einen pKa-Wert von 4,75 ergibt. Dies entspricht einer Dissoziation von nur etwa 0,1% der Moleküle, was im Vergleich zu starken anorganischen Säuren mit einem Dissoziationsgrad von 100% bestätigt, dass es sich um sehr schwache Säuren handelt. Im Vergleich zu den Alkoholen, deren Gleichgewichtskonstanten in der Größenordnung von 10-16 oszillieren, sind die Carbonsäuren dagegen viel stärker. Trotz ihrer strukturellen Ähnlichkeit ist diese Tatsache auf die Beständigkeit des Carboxylat-Anions gegenüber dem Alkoholat-Anion zurückzuführen. Es sei daran erinnert, dass die negative Ladung in Alkoholaten an einem einzelnen Sauerstoffatom liegt, das stark elektronegativ ist. Bei Carboxylat-Anionen hingegen ist die Ladung zwischen den beiden Sauerstoffatomen der funktionellen Gruppe delokalisiert. Dadurch ist es stabiler als das Anion, das durch Alkohole erzeugt wird.
Gewinnung von Carbonsäuren
- Oxidation von substituierten Alkylbenzolen mit KMnO4 oder Na2Cr2O7 mit einem Produkt in Form von substituierten Benzoesäuren. Die Oxidation von primären und sekundären Alkylgruppen ist möglich.
- Oxidation der Bindung C=C in Alkenen mit mindestens einem Vinylwasserstoffatom mit Hilfe von KMnO4
- Oxidation von primären Alkoholen und Aldehyden, Alkohole mit Jones-Reagenz und Aldehyde mit demselben Reagenz und alkalischem Silberoxid,
- Hydrolyse von Nitrilen unter Einwirkung von starken, heißen Lösungen von Säuren oder Basen,
- Reaktion von Grignard-Verbindungen mit Kohlendioxid, wobei als Zwischenprodukt Magnesiumcarboxylat entsteht. Die Zwischenverbindung reagiert dann mit einer Säure.
Reaktionen der Carbonsäuren
Aufgrund ihrer Struktur durchlaufen Carbonsäuren neben ihren charakteristischen Reaktionen ähnliche Umwandlungen wie Alkohole und Ketone. Wie Alkohole können sie ein Proton unter Bildung eines nukleophilen Reagenzes abspalten. Wie die Ketone werden sie durch andere nukleophile Stoffe am Kohlenstoffatom der Carbonylgruppe angegriffen. Darüber hinaus sind Reduktion, Substitution an der Alpha-Position, nukleophile Substitution der Acylgruppe und Deprotonierung (Dissoziation) möglich.
Die Reduktion der Carbonsäuren findet gegenüber LiAlH4 statt, wobei das Produkt in Form eines primären Alkohols entsteht. Manchmal ist es notwendig, eine Erwärmung in einer Tetrahydrofuranlösung zu verwenden, um die Effizienz zu erhöhen. Eine andere Möglichkeit ist die Reduktion mit Hilfe von Borat in Tetrahydrofuranlösung, wobei ebenfalls 1o-Alkohole entstehen.