Per Definition ist die chemische Aktivität die Fähigkeit eines Elements, in chemischen Reaktionen Elektronen abzugeben. In der Praxis nimmt ihre Aktivität zu, wenn die Elektronegativität - ein Maß für die Fähigkeit eines Elements, Elektronen anzuziehen - abnimmt. Wenn ein Metall Elektronen weniger stark anzieht, ist es reaktionsfreudiger. Zur Klassifizierung der chemischen Aktivität von Metallen wird ein Referenzelement, Wasserstoff, verwendet. Ein Maß für die Aktivität eines Metalls ist seine Fähigkeit, Wasserstoff aus Säuren oder Wasserstoff aus einem Wassermolekül zu verdrängen.

Chemische Aktivitätsreihen von Metallen
Dieser Begriff bezeichnet das Nebeneinander von chemischen Elementen, die von Natur aus metallisch sind, in einer bestimmten Reihenfolge von der geringsten bis zur höchsten chemischen Aktivität. Dies dient dem Vergleich der Aktivität verschiedener Metalle. Neben den Metallen umfasst die Palette der chemischen Aktivitäten auch ein Nichtmetall, den Wasserstoff, Wasserstoff, welcher als Referenzelement dient.
Je höher ein Metall in der Aktivitätsreihe steht, desto reaktiver ist es. Es ist auch damit verbunden, dass es leichter oxidiert und daher ein stärkeres Reduktionsmittel wie auch ein chemisch aktiveres Element ist. Im Gegensatz dazu ist ein Metall umso weniger reaktiv, je weiter unten es in der Aktivitätsreihe steht. Dies bedeutet, dass es leichter eine Reduktionsreaktion durchläuft, daher also ein stärkeres Oxidationsmittel und weniger aktives Element ist.
Anhand der Werte in Tabelle 1 lässt sich erkennen, dass das Metall umso stärker reduziert und chemisch reaktiver ist, je niedriger der Wert des Standardpotenzials eines Elements ist. Ein Maß für die Fähigkeit zur Elektronenabgabe in einer Reihe von Metallaktivitäten ist ihr Standardpotenzialwert. Für Wasserstoff bzw. die Wasserstoff-Elektrode wird das Standardpotenzial mit Null angenommen. Das Standardpotential ist die elektromotorische Kraft einer Zelle, die aus einer Standard-Wasserstoff-Halbzelle und der interessierenden Halbzelle besteht, in der die Konzentrationen der Substrate und Produkte 1 mol/dm3 betragen.
| Elektrode | Standard-Potenzial [V] |
| Li/Li+ | -3,04 |
| Ca/Ca2+ | -2,86 |
| Mg/Mg3+ | -2,36 |
| Al/Al3+ | -1,69 |
| Mn/Mn2+ | -1,18 |
| Zn/Zn2+ | -0,76 |
| Cr/Cr3+ | -0,74 |
| Fe/Fe2+ | -0,44 |
| Cd/Cd2+ | -0,40 |
| Co/Co2+ | -0,28 |
| Ni/Ni2+ | -0,26 |
| Sn/Sn2+ | -0,14 |
| Pb/Pb2+ | -0,14 |
| Fe/Fe3+ | 0,04 |
| H2/2H+ | 0,00 |
| Bi/Bi3+ | +0,32 |
| Cu/Cu2+ | +0,34 |
| Ag/Ag+ | +0,80 |
| Hg/Hg2+ | +0,85 |
| Au/Au3+ | +1,52 |
Tabelle 1. Elektrochemische Reihen von Metallen
Die oben in der Reihe sichtbaren Metalle sind die aktivsten. Diejenigen, die über Wasserstoff liegen, neigen dazu, leicht zu oxidieren und sind daher stärkere Reduktionsmittel als dieser. Elemente, die in der Reihe unterhalb von Wasserstoff liegen, reduzieren sich leichter und sind stärkere Oxidationsmittel. Wenn ein Metall ein negativeres Potenzial als ein anderes aufweist, bedeutet dies, dass es dieses aus seinem Salz verdrängt. So verdrängt Eisen beispielsweise Kupfer in Kupfersalzen, aber Kupfer verdrängt Eisen nicht aus seinen Salzen. Stattdessen kann es Silber aus Silbersalzen verdrängen. Lithium und Beryllium aus Lösungen von Salzen anderer Metalle verdrängen diese nicht, sondern reagieren direkt mit Wasser. Sie verdrängen Wasserstoff und bilden ihre eigenen Verbindungen – Hydroxide. Solche Metalle werden als aktive Metalle bezeichnet.
Metallaktivität und das Periodensystem der Elemente
Wie viele andere Eigenschaften lässt sich auch die chemische Aktivität eines Elements durch seine Stellung im Periodensystem erklären. Die aktivsten Metalle sind die der Gruppen I und II, da sie leicht Wasserstoff aus dem Wasser verdrängen und Hydroxide bilden. Die chemische Aktivität der Metalle als Gruppe nimmt mit steigender Ordnungszahl zu. Die Periode nimmt mit steigender Ordnungszahl ab.

Edelmetalle und unedle Metalle
Wasserstoff bietet nicht nur einen Bezugspunkt für die Aktivität, sondern trennt auch die Edelmetalle von den unedlen Metallen. Als unedle Metalle werden diejenigen bezeichnet, die über dem Wasserstoff angesiedelt sind. Beide reagieren mit Säuren und verdrängen dabei Wasserstoff aus diesen. Von Kalium bis hin zu Kalzium reagieren sie bereits bei Raumtemperatur mit Wasser, von Magnesium bis hin zu Eisen reagieren sie bei höheren Temperaturen mit diesem.
Alle Metalle, die in der Aktivitätsreihe unterhalb von Wasserstoff stehen, verdrängen keinen Wasserstoff aus Säuren. Sie können jedoch mit oxidierenden Säuren unter Bildung der entsprechenden Salze und Oxide, die durch Reduktion des Säurerestes entstehen, reagieren.
Die Elemente am unteren Ende der Reihe, von Silber bis Gold, sind so resistent gegen chemische Reaktionen, dass sie nur mit Königswasser reagieren. Eine solche Lösung ist ein Gemisch aus einer konzentrierten Salzsäurelösung und einer konzentrierten Salpetersäurelösung (V), gemischt im Volumenverhältnis 3:1. Daraus lässt sich ableiten, dass mehrere Reaktionen durchgeführt werden können, um die Aktivität des interessierenden Elements zu unterscheiden: mit Wasser bei Raumtemperatur, mit heißem Wasser, mit nicht oxidierender Säure, mit oxidierender Säure und mit königlichem Wasser.
Experiment zum Nachweis von Metallen, die Wasserstoff aus Säuren verdrängen
Der einfachste Weg, die Aktivität von Metallen zu bestätigen, ist die Durchführung eines Experiments. Zu diesem Zweck werden zehn Reagenzgläser vorbereitet, in die nacheinander in den Stufen 1-5 Magnesiumband, Zinkdraht, Eisendraht, Nickeldraht und Kupferdraht eingelegt werden. Die gleiche Reihenfolge sollte in den Rohren 6-10 wiederholt werden. Anschließend gibt man in die Röhrchen 1-5 einige Milliliter Salzsäure und in die Röhrchen 6-10 einige Milliliter verdünnte Schwefelsäure (VI). An jedes Röhrchen wird ein brennendes Kienholz angelegt. In Reagenzgläsern mit Magnesiumbändern und Eisen-, Zink- und Nickeldrähten, die mit Säuren geflutet werden, treten Gasblasen aus. Die stärkste Freisetzung ist in Röhren zu beobachten, die Magnesium enthalten. Es finden folgende Reaktionen statt:
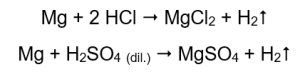
Die Menge des ausgestoßenen Gases nimmt in der Reihe Zink, Eisen, Nickel ab. Entsprechend finden dort Reaktionen statt:

In Röhren, die Kupferdrähte enthielten, ist kein Gas sichtbar, keine Veränderung. Dies bedeutet, dass derartige Reaktionen nicht auftreten:
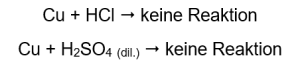
Wenn ein Kienholz gezündet wird, ist in den Röhren, aus denen das Gas austritt, ein charakteristisches Geräusch zu hören.
Zusammenfassung der Beobachtungen und Schlussfolgerungen:
Magnesium, Zink, Eisen und Nickel reagieren sowohl mit Salzsäure als auch mit Schwefelsäure (VI). Beide verdrängen Wasserstoff aus der Säure, was bedeutet, dass sie in der Aktivitätsreihe der Metalle weiter oben stehen als die Säure. Bei den Reaktionen entstehen Produkte in Form von Salzen und ein Gas, Wasserstoff, der freigesetzt wird.
Das charakteristische Geräusch, das beim Anlegen eines glühenden Bogens an ein Reagenzglas mit austretendem Gas entsteht, wird durch die Reaktion von Wasserstoff mit Sauerstoff verursacht.
Von allen getesteten Metallen ist Magnesium am reaktivsten, gefolgt von Zink, Eisen, Nickel und Kupfer. Die Intensität der Gasblasen gibt Aufschluss über die Aktivität des Metalls.
Bei den Röhrchen, die Kupfer enthielten, wurden keine Veränderungen festgestellt. Dies zeigt, dass Kupfer nicht in der Lage ist, Wasserstoff aus Salzsäure oder verdünnter Schwefelsäure (VI) zu verdrängen.