Bei chemischen Reaktionen kommt es nur bei einer Minderheit zu einer vollständigen Umwandlung von Substraten in Produkte. Die überwiegende Mehrheit, einschließlich derer, die in unserem Körper stattfinden, ist reversibel. Bei solchen Prozessen stellt sich ein chemisches Gleichgewicht ein. Dies ist ein äußerst wichtiger Begriff in der Chemie, mit dem zum Beispiel das Prinzip vom kleinsten Zwang verbunden ist. Die Kenntnis der grundlegenden Gesetze und Regeln des chemischen Gleichgewichts ermöglicht es beispielsweise, viele Reaktionen vorherzusagen oder technologische Prozesse effizienter durchzuführen.
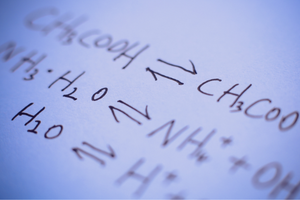
Reversible und irreversible Reaktionen
Betrachtet man den Ablauf chemischer Reaktionen, so kann man allgemein zwischen reversiblen und irreversiblen Reaktionen unterscheiden. Es sollte jedoch bedacht werden, dass es in der Realität keine 100%ig irreversiblen Reaktionen gibt und die Einstufung in eine bestimmte Gruppe auf dem vorherrschenden Endergebnis basiert.
Irreversible Reaktionen
In diesem Fall werden die Substrate im System in bestimmte Produkte umgewandelt. Im Gegensatz dazu findet keine Rückumwandlung – von Produkten in Substrate – statt. In der Notation wird ein einzelner Pfeil zwischen den Reaktanten markiert, wobei die Pfeilspitze auf die Produkte zeigt.
Irreversible Reaktionen sind vor allem solche, bei denen sich Niederschläge bilden. In der Praxis sind diese in Wasser unlöslich und können nicht rekonstituiert werden. Die Reversibilität des Prozesses ist auch bei Reaktionen, die in offenen Systemen ablaufen, d.h. z. B. in einem Becherglas oder einem Kugelkolben, aus dem eines der gebildeten Produkte, wie z.B. Kohlendioxid, frei entweichen kann, schwer zu erreichen. Durch Änderung der Reaktionsbedingungen, d.h. durch Verlagerung der Reaktion in ein geschlossenes System, kann sie jedoch reversibel gemacht werden. Zur Gruppe der irreversiblen Reaktionen gehören auch alle Prozesse, bei denen die Wechselwirkung zwischen den Produktmolekülen wesentlich geringer ist als zwischen den Substraten. Ein solcher Prozess läuft also in zwei Richtungen ab, aber da die Rückgewinnung der Substrate verschwindend gering ist, wird er in der Praxis als irreversible Reaktion eingestuft.
Reversible Reaktionen
Das sind Reaktionen, bei denen aus Substraten Produkte gebildet werden und gleichzeitig der umgekehrte Prozess mit vergleichbarer Intensität abläuft, die Rekonstitution von Substraten aus Produkten. In der Reaktionsaufzeichnung befinden sich zwei Pfeile zwischen den Reaktanten, wobei die Pfeilspitzen in entgegengesetzte Richtungen zeigen, um die Umkehrbarkeit der ablaufenden Reaktionen anzuzeigen.
Reversible Reaktionen sind hauptsächlich solche, die in geschlossenen Systemen ablaufen. Die Substrat- und Produktmoleküle werden daran gehindert, die Reaktionsumgebung zu verlassen, und stoßen miteinander zusammen, wodurch Produkte gebildet und Substrate rekonstituiert werden. Ein Beispiel für eine solche Reaktion ist die Bildung von Jodwasserstoff aus Iod und Wasserstoff.
Zustand des chemischen Gleichgewichts
Ob eine Reaktion ablaufen kann, reversibel oder irreversibel ist, hängt weitgehend von den gegebenen Prozessbedingungen und der Art des Prozesses ab. Findet eine reversible Reaktion statt, d.h. Substrate werden durch die chemische Reaktion in Produkte umgewandelt und gleichzeitig werden Substrate durch Zusammenstöße zwischen Produktmolekülen neu gebildet, so stellt sich bei diesen Reaktionen irgendwann ein chemischer Gleichgewichtszustand ein. Mit anderen Worten kann man sagen, dass die Konzentrationen von Substraten und Produkten im System konstant sind – ihre Menge ändert sich trotz des kontinuierlichen Ablaufs der Reaktion nicht. Im chemischen Gleichgewicht sind die Reaktionsgeschwindigkeiten in beiden Richtungen gleich hoch. Das chemische Gleichgewicht ist unter bestimmten Bedingungen der Zustand größter Stabilität für ein bestimmtes System. Der Energiebedarf ist dann gering.
Die chemische Gleichgewichtskonstante K ist ein Koeffizient, der das Gleichgewicht von zwei reversiblen Reaktionen beschreibt. Sie ist definiert als der Quotient der Produkte der Konzentrationen von Produkten und Substraten, potenziert mit den stöchiometrischen Koeffizienten, die im chemischen Gleichgewicht gemessen wurden. Die Formel für die Konstante wurde 1864 als sogenanntes Massenwirkungsgesetz formuliert. Dabei ist zu beachten, dass es sich um eine reaktionsspezifische Größe handelt.
Der Zustand des chemischen Gleichgewichts wird durch eine Reihe von Faktoren beeinflusst. Hier sind einige von ihnen: Hier sind einige von ihnen:
- Temperatur,
- Volumen des Reaktionssystems,
- Druck,
- Konzentration der Reaktanten.
Wichtig ist, dass die Lage des Gleichgewichtszustands nicht durch die Zugabe oder Änderung des Reaktionskatalysators beeinflusst wird. Seine Funktion besteht lediglich darin, die Zeit zu verkürzen, in der das Gleichgewicht erreicht wird.
Das Prinzip vom kleinsten Zwang
Durch die Änderung bestimmter Bedingungen der Reaktion kann ihr Gleichgewichtszustand beeinflusst werden. Das System wird ständig versuchen, das Gleichgewicht aufrechtzuerhalten, da dies für ihn energetisch vorteilhaft ist (geringster Energieaufwand). Folglich wird es Veränderungen geben, um Faktoren entgegenzuwirken, die das System aus dem Gleichgewicht bringen. Dieses Phänomen wurde 1881 erklärt und ist heute als das Prinzip von Le Chatelier oder als das Prinzip vom kleinsten Zwang bekannt. Es ermöglicht uns zu verstehen, wie ein System auf Änderungen der Bedingungen einer Reaktion, die sich im chemischen Gleichgewicht befindet, reagiert.
Die Zugabe eines der Reaktanten zu dem System führt zu einem Ungleichgewicht. Die Konzentrationen der einzelnen Reaktanten ändern sich. Um dem entgegenzuwirken, versucht das System, mehr Produkt zu produzieren (wenn ein Substrat hinzugefügt wurde) oder das Substrat wiederherzustellen (wenn eine bestimmte Menge an Produkt hinzugefügt wurde).
Die Änderung der Temperatur einer Reaktion hat einen großen Einfluss, insbesondere bei endothermen und exothermen Prozessen. Im ersten Fall ist es notwendig, dem System Energie in Form von Wärme zuzuführen, sodass eine Erhöhung der Temperatur des gesamten Prozesses das Gleichgewicht nach rechts (Senkung nach links) in Richtung der Bildung von mehr Produkt verschiebt. Das Gegenteil ist der Fall bei exothermen Reaktionen, bei denen eines der Produkte Wärme ist. Die Temperatur hat keinen Einfluss auf das Gleichgewicht einer Reaktion, bei der keine thermische Wirkung beobachtet wird.
Bei Reaktionen, die in der Gasphase ablaufen, ist dagegen der Druck ein sehr wichtiger Aspekt. Eine Erhöhung des Wertes dieses Parameters, d.h. zum Beispiel eine Verringerung des Reaktionsvolumens des Systems, führt zu einer Verschiebung des Gleichgewichts der Reaktion. Die Richtung der Änderungen hängt von den stöchiometrischen Koeffizienten in der Reaktionsgleichung ab. Dieser Parameter hat keinen Einfluss auf den chemischen Gleichgewichtszustand einer Reaktion, bei der die Summe der stöchiometrischen Koeffizienten der gasförmigen Substrate und Produkte gleich ist.
Man sollte daran denken, dass, wenn ein System aus dem chemischen Gleichgewicht gerissen wird, greift das Prinzip vom kleinsten Zwang und es kommt zum Erreichen eines neuen Gleichgewichtszustandes als Ergebnis.