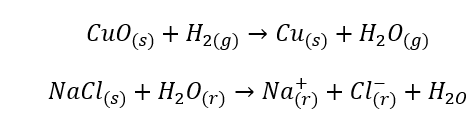Die Betrachtung von Phänomenen und Prozessen muss vielschichtig sein. Es müssen sowohl mikroskopische als auch makroskopische Eigenschaften berücksichtigt werden. Wie die Namen schon andeuten, erfolgt diese Einteilung durch eine Trennung der Größenordnungen der analysierten Elemente. Der makroskopische Bereich, der eng mit der Thermodynamik chemischer Reaktionen zusammenhängt, ermöglicht die Beobachtung und Messung physikalischer und chemischer Eigenschaften, wie z.B. Dichte, Temperatur oder Löslichkeit. Bei der mikroskopischen Analyse können die Bewegungen der Moleküle und ihre Wechselwirkungen beobachtet werden. Wir können die Moleküle in Bezug auf ihre Geschwindigkeit und kinetische Energie beschreiben. Wenn es sich bei unserem Interessengebiet um ein Gemisch handelt, müssen wir seine Homogenität und folglich die Art des Systems, in dem es auftritt, berücksichtigen.

Klassifizierung der physikalisch-chemischen Systeme
Bei der Betrachtung der Homogenität materieller Systeme wird auf makroskopischer Ebene zwischen zwei Hauptgruppen unterschieden: heterogene Systeme und homogene Systeme. Dabei handelt es sich um eine Kategorisierung nach ihren physikalischen Eigenschaften – Aggregatzustand, Löslichkeit, Schmelzpunkt, die sich unterscheiden oder nicht. Jedes System besteht aus allen Substanzen, die an der Reaktion oder dem Prozess beteiligt sind. Ein bestimmter Teil eines Systems, der durch die Beibehaltung derselben Eigenschaften gekennzeichnet ist, wird als Phase bezeichnet. Es gibt drei grundlegende Arten von Phasen – Feststoff, Flüssigkeit und Gas. Die Fläche zwischen diesen und dem Rest des Systems stellt die Phasengrenze dar. Je nach Entropie (ΔS) oder freier Enthalpie (ΔG) können Phasenübergänge von der einen in die andere Phase spontan erfolgen, wenn ΔS>0 oder ΔG<0 ist.
Phasendiagramm
Eine grafische Darstellung des Auftretens der verschiedenen Phasen ist das Phasendiagramm. Er berücksichtigt das Auftreten der jeweiligen Phasen bei Erreichen bestimmter Temperatur- und Druckbereiche und deren Wechsel untereinander. Ein schematisches Phasendiagramm für ein Einkomponentensystem veranschaulicht die Existenz der drei Hauptphasen in Abhängigkeit von den Bedingungen der Prozessführung. Die darauf befindlichen Linien zeigen die Gleichgewichtszustände zwischen den jeweiligen beiden Phasen an, d.h. zwischen Feststoff und Gas, Feststoff und Flüssigkeit sowie Gas und Flüssigkeit. Wenn wir einen der kritischen Parameter kennen, können wir also bestimmen, unter welchen Bedingungen das Schmelzen, Erstarren, Verdampfen, Kondensieren, Sublimieren und Resublimieren der beschriebenen Komponente stattfinden wird. Darüber hinaus gibt es im Diagramm einen Tripelpunkt, an dem alle Phasenlinien zusammenlaufen, was auf die Möglichkeit hinweist, dass die drei Phasen unter bestimmten Bedingungen gleichzeitig existieren. Das Diagramm enthält auch zwei sehr wichtige Punkte – den kritischen Druck und die kritische Temperatur. Der kritische Druck bestimmt den Punkt, der den maximalen Druck widerspiegelt, bei dem eine Flüssigkeit in ein Gas umgewandelt werden kann, oder den höchstmöglichen Druck des gesättigten Dampfes über einer Flüssigkeit. Der Begriff der kritischen Temperatur hingegen definiert die höchste Temperatur, bei der ein Gas bei steigendem Druck verflüssigt werden kann. Der kritische Punkt, der sich bei der kritischen Temperatur und dem kritischen Druck befindet, beschreibt somit einen Zustand, in dem flüssige und gasförmige Phasen nicht voneinander zu unterscheiden sind.
Gibbssche Phasenregel
Dies ist eine spezifische Beziehung, die für jedes System gilt, das sich im thermodynamischen Gleichgewicht befindet. Die Gleichung, die diese Regel definiert, umfasst die Anzahl der im System vorhandenen Phasen (f) mit der Anzahl der unabhängigen Komponenten (n) und der Anzahl der Freiheitsgrade (s). Die Zahl s entspricht der Anzahl der anpassungsfähigen intensiven Variablen, deren Änderung nicht zu einer Störung der Phasenzahl im Gleichgewicht des isolierten Systems führt. Als intensive Variablen gelten alle physikalischen Größen, die in keiner Weise vom System abhängig sind, z.B. die geometrischen Größen und das Volumen sowie die Anzahl der Moleküle im System, seine Masse, die spezifische Wärme und ähnliches. Die Gleichung hat die Form:
Die mit dem Buchstaben n bezeichneten unabhängigen Komponenten des Systems bedeuten in der Praxis die kleinste Anzahl von Komponenten des betrachteten Systems, die notwendig ist, um jede seiner Phasen in beliebiger Menge zu bilden. Wenn es sich um ein System handelt, dessen Komponenten miteinander reagieren können, wird die Zahl n berechnet, indem man die Zahl der unabhängigen Reaktionsgleichungen von der Gesamtzahl der Komponenten des Systems abzieht. Das heißt, wenn für die Reaktion die folgende Notation verwendet wird:
![]()
beträgt die Anzahl der unabhängigen Gleichungen 1 – wir betrachten eine konkrete Reaktion, die in dem System stattfindet. Als unabhängige Gleichung bezeichnet man ein System chemischer Gleichungen, bei dem es unmöglich ist, eine der Gleichungen durch Kombination der anderen zu erhalten. Die Anzahl der Komponenten dieses Systems beträgt jedoch 3, vorhanden sind CaCO3, CaO und CO2. Mit dieser Information können wir auch die Anzahl der unabhängigen Komponenten berechnen:
n = Anzahl der Komponenten – Anzahl der unabhängigen Gleichungen, also:
n = 3 – 1 = 2
Anhand desselben Beispiels können wir auch die Anzahl der Freiheitsgrade berechnen, indem wir die Gleichung der Gibbsschen Phasenregel verwenden:
s = n – f + 2 = 2 – 3 + 2 = 1
Dieser Wert bedeutet, dass wir, um die Anzahl der Phasen im Gleichgewicht des Systems stabil zu halten, nur mit einer intensiven Variablen arbeiten können.

Heterogenes System
Jedes System, in dem mehr als eine Phase vorhanden ist, und somit ein inhomogenes System, ist auch heterogen. Dabei spielt es keine Rolle, um welche Art von Phasen es sich handelt – ein heterogenes System kann mehrere feste und flüssige Phasen, aber jeweils nur eine Gasphase enthalten. Dies ist darauf zurückzuführen, dass sich die Gase perfekt vermischen lassen.
Ein interessantes Beispiel für ein heterogenes System ist Granit – er enthält viele feste Phasen, darunter Quarz, Kalifeldspat, Plagioklas und Biotit. Viele Lebensmittel können auch als heterogen bezeichnet werden – Mehrkomponenten-Müsli oder Salatdressings, die aus Fett und Gewürzen und anderen Zusatzstoffen bestehen, sind hervorragende Beispiele dafür.
Ein interessanter Typ von heterogenen Gemischen sind Kolloide, d.h. Lösungen, bei denen ein Mikroskop erforderlich ist, um die Bestandteile zu unterscheiden. In den meisten Fällen ist es jedoch möglich, sie durch einfache Methoden oder mit einfachen Werkzeugen zu trennen. Um zum Beispiel ein Gemisch aus Wasser und Öl zu trennen, können wir das Dekantieren verwenden – die Bestandteile sind mit bloßem Auge sichtbar. Andere Methoden, die sich für die Trennung heterogener Gemische eignen, sind Filtration, mechanische Trennung oder Zentrifugation. Das Gleiche gilt für Gemische von Mineralien, die sich in ihren Eigenschaften unterscheiden – Quarz, Glimmer und Feldspat können sogar mit einem Hammer getrennt werden.
Homogenes System
Im Gegensatz zu einem heterogenen System ist ein homogenes System durch den Gehalt an nur einer Phase gekennzeichnet – es ist einheitlich. In diesem Fall können wir die Komponenten des Systems nicht mit bloßem Auge erkennen. Auch einfache Trennmethoden sind nicht effektiv, und nur Methoden, die auf physikalischen Eigenschaften beruhen, können nützlich sein. Ein Beispiel für eine solche Methode ist die Trennung durch Destillation, die auf den unterschiedlichen Siedepunkten eines bestimmten Systems beruht. Andere Methoden, die sich für die Trennung homogener Gemische eignen, sind die Kristallisation und die Chromatographie. Eine besondere Art von homogenem System ist eine reine Substanz, deren einzige Phase nur eine Komponente enthält. Ein weiterer Fall sind alle Arten von homogenen Lösungen und Gemischen – obwohl das System nur eine Phase hat, kann es mehrere Komponenten enthalten. Da die im System vorhandene Phase entweder eine Flüssigkeit, ein Feststoff oder ein Gas sein kann, können Lösungen auch diese Formen annehmen. Beispiele für diese Art von Systemen sind flüssige Gemische – Essig, Wasser, gasförmige Gemische – atmosphärische Luft, und Gemische aus festen Stoffen, einschließlich Mineralerzen und allen Arten von Legierungen wie Bronze oder Messing.
Umwandlungen in Systemen
In Systemen sind zwei Arten von Umwandlungen möglich – Phasenumwandlungen, die seltener als physikalische Umwandlungen bezeichnet werden, und chemische Umwandlungen. Erstere sind alle Umwandlungen, die nicht zu neuen chemischen Substanzen führen. Sie sind auch nicht durch das Verschwinden bereits vorhandener Bestandteile gekennzeichnet. Wie der Name schon sagt, führen sie jedoch zu solchen Veränderungen im Aggregatzustand oder in der Struktur. Es ist auch möglich, dass sich eine neue Phase bildet, bei gleichzeitigem Verschwinden der ursprünglichen Phase. Beispiele für Phasenumwandlungen sind Resublimation und polymorphe Umwandlungen von Elementen. Chemische Umwandlungen haben einen völlig anderen Mechanismus. Dabei handelt es sich nämlich um Reaktionen, bei denen anstelle der ursprünglichen Bestandteile neue Substanzen gebildet werden. Solche Umwandlungen können in zwei Varianten stattfinden – zum Beispiel während der Hydrolyse in einer Phase oder in mehreren Phasen und während der Verbrennung.
Chemische Reaktionen
- Homogene Reaktionen, auch einheitliche Reaktionen genannt, liegen vor, wenn sich das gesamte System, einschließlich der Substrate und Produkte, in einer Phase befindet, z. B:
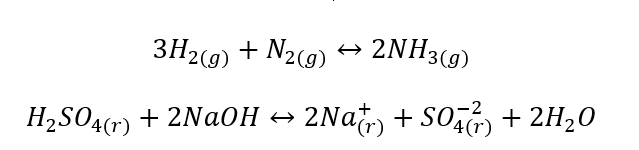
- Heterogene Reaktionen – inhomogen, sind Reaktionen, bei denen sich das System und darin die Substrate und Produkte in mindestens zwei verschiedenen Phasen befinden. Solche Reaktionen finden immer an der Grenze der Phasentrennung statt, z.B.: