In der Chemie gehen einige chemische Verbindungen besondere Bindungen mit Wassermolekülen ein. Dabei handelt es sich nicht um chemische Bindungen, sondern um Wechselwirkungen mit kurzer Reichweite, die die Eigenschaften dieser Verbindungen bestimmen. Es handelt sich um Hydrate, die auch als hydratisierte Verbindungen bezeichnet werden. Ihre Eigenschaften werden in ausgewählten Industriezweigen gerne genutzt. Das bekannteste Salzhydrat ist zweifellos Gips oder Calciumsulfat-Dihydrat, das ein wichtiger Rohstoff für die Bauindustrie ist. Hydrate sind auch sehr gute Indikatoren für den Feuchtigkeitsgehalt. Dies hängt damit zusammen, dass die Farbe von wasserfreien Salzes oft anders ist als die von hydratisiertem Salz.

Hydrate, oder hydratisierte Verbindungen
Hydrate sind keine chemischen Verbindungen, bei denen zwischen den Wassermolekülen und den Molekülen des gewählten Salzes chemische Anbindungen, wie z.B. kovalente Bindungen, vorkommen. Es sind auch keine Koordinationskomplexe. Charakteristisch für diese Strukturen ist die Bildung von Wasserstoffbrücken, die viel schwächer sind als chemische Bindungen. Hydrate sind in Form eines Kristallgitters aufgebaut. Die Wassermoleküle sind darin unregelmäßig verteilt. Der Begriff Kristallisationswasser ist häufig anzutreffen.
Hydrate werden durch Hydratation gewonnen. Salzmoleküle, insbesondere Derivate anorganischer Säuren, sind am ehesten für diese Reaktion geeignet. Bei der Hydratation werden wasserfreie Kristalle in hydratisierte Kristalle umgewandelt. Sie kann eine Veränderung der Mineralmasse bewirken, zerstört sie aber nicht. Die Hydratisierung geht häufig mit anderen Prozessen einher, wie z. B. der Karbonisierung. Hydratisierungschemikalien zeichnen sich unter normalen Bedingungen durch eine hohe Hygroskopizität aus, d. h. durch eine starke Affinität zu Wassermolekülen. Solche Stoffe sind beispielsweise in der Lage, Feuchtigkeit aus der Luft zu absorbieren. Eine weitere Möglichkeit, Hydrate zu erhalten, ist die Kristallisation aus wässrigen Lösungen.
Die Summenformeln der Hydrate werden gebildet, indem man die Salzformel aufschreibt und die Anzahl der hydratisierten Wassermoleküle angibt. Um eine allgemeine Schreibweise zu ermöglichen, wird der Buchstabe „n“ vor„H2O“ gesetzt. Er nimmt Werte größer als eins an und entspricht der Anzahl der gebundenen Wassermoleküle. Am häufigsten wird zwischen Hydraten mit n=½ (Hemihydrat), n= 1 (Monohydrat), n=2 (Dihydrat) und n=3 (Trihydrat) unterschieden. Wichtig ist, dass ein und dieselbe Substanz eine unterschiedliche Anzahl von Wassermolekülen an sich binden kann.
![]()
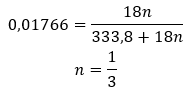
Da zwischen den Salzmolekülen und den Wassermolekülen Wasserstoffbrücken bestehen, weisen diese Verbindungen keine zufriedenstellende Beständigkeit gegenüber erhöhten Temperaturen auf. Wenn sie erhitzt werden, zerfallen sie und gehen in die wasserfreie Form über. Hydrate lösen sich sehr gut in Wasser auf. In wässrigen Lösungen werden hydratisierte Wassermoleküle, die an Salz gebunden sind, freigesetzt. Diese Tatsache sollte beispielsweise bei der Herstellung von Lösungen mit diesen Stoffen berücksichtigt werden. Wird der Hydratationsgrad einer bestimmten Verbindung nicht berücksichtigt, führt dies zu Fehlern, und sei es nur bei der Bestimmung der Konzentration der Lösung. Ein wichtiges Merkmal hydratisierter Salze ist die Veränderung ihrer Farbe, die auf die Anlagerung von Wassermolekülen bei der Hydratationsreaktion zurückzuführen ist. Anzumerken ist hier, dass die hydratisierten Formen im Vergleich zu den wasserfreien Salzen eine deutlich geringere Hygroskopizität aufweisen.
Hydrate anorganischer Verbindungen
Salze anorganischer Säuren sind diejenigen Stoffe, die eindeutig am häufigsten Hydrate mit Wassermolekülen bilden. Zu den häufigsten Hydraten anorganischer Verbindungen gehören:
- Kupfer(II)-sulfathydrat, CuSO4 – Kupfer(II)-sulfathydrat nimmt verschiedene Hydratationsgrade an. Die maximale Anzahl der angebundenen Wassermoleküle beträgt fünf. Durch das Erhitzen des Pentahydrats dieses Salzes werden Wassermoleküle abgespalten. Zunächst sind dies zwei, wodurch ein Trihydrat entsteht, und bei weiterer Erwärmung erhält man Kupfer(II)-Sulfat (IV)-Monohydrat. Um das letzte Wassermolekül zu entfernen, muss die Verbindung auf eine Temperatur von mehr als 200 ᵒC erhitzt werden. Kupfer(II)-Sulfat (IV)-Monohydra nimmt eine blaue Farbe an, die auf das Vorhandensein von Kristallwasser um die Kupferionen herum zurückzuführen ist. Das wasserfreie Salz hingegen ist weiß. Seine hohe Hygroskopizität und die Fähigkeit, Hydrate zu bilden, werden zur Entfernung von Feuchtigkeit aus einigen Flüssigkeiten verwendet.
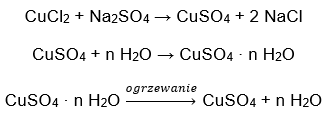
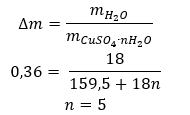
- Kobalt(II)-chloridhydrat,CoCl2 – wasserfreies Kobalt(II)-chlorid ist stark hygroskopisch. Dank seiner starken Affinität zu Wassermolekülen ist es in der Lage, auch Feuchtigkeit aus der Luft zu absorbieren. Dieser Prozess führt zur Bildung von Hydraten dieses Salzes. Die häufigste hydratisierte Form ist Kobalt(II)-chloridhexahydrat – CoCl2 * 6H2O. Eine weitere Form ist das Dihydratmolekül. Dieses Salz hat auch die Fähigkeit, seine Farbe je nach Feuchtigkeitsgehalt zu verändern. Das wasserfreie Salz ist blau, das Dihydrat nimmt eine rosa-violette Farbe an, und das Hexahydratmolekül hat eine intensiv rote Farbe.
- Natriumsulfathydrat, Na2SO4 – dieses Salz liegt in Form von zwei Hydraten vor: Heptahydrat (fünf Wassermoleküle in der Struktur) und Decahydrat (zehn Wassermoleküle in der Struktur). Die wasserfreie Form von Natriumsulfat kommt in der Natur als das seltene Mineral Tenardit vor. Natriumsulfat-Tenhydrat ist das so genannte Glaubersalz. Es findet breite Verwendung bei der Herstellung von Glas, Papier, Waschmittel und Soda. Glaubersalz ist auch eine der notwendigen Zutaten für die Herstellung des blauen Pigments Ultramarin. Darüber hinaus hat die Verbindung aufgrund ihrer abführenden Wirkung eine therapeutische Wirkung auf das Verdauungssystem.

Gips
Ein Beispiel für ein anorganisches Salzhydrat von weltweiter Bedeutung und breiter Anwendung ist Gips. Es ist ein Mineral, das aus der hydratisierten Form von Calciumsulfat, CaSO4, besteht. Der kristalline Gips ist das Dihydrat dieses Salzes. Unter natürlichen Bedingungen entsteht es bei der Verdunstung von Salzwasser aus Seen und Flüssen, bei Temperaturen unter 42ᵒC. Wasserfreies Calciumsulfat ist Anhydrit. Er wird auch als wasserfreier Gips bezeichnet. Baugips hingegen ist ein Calciumsulfat-Halbhydrat. Welche Form dieses Salzes gewonnen wird, hängt von der Temperatur ab, die bei der Verarbeitung des Sedimentgesteins herrscht. Gips, der im Bauwesen verwendet wird, ist in der Regel eine Mischung aus verschiedenen Formen von Kalkhydratsalz.
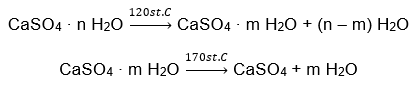
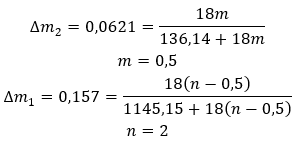
Die Anwendungsmöglichkeiten für Gips sind sehr vielfältig, insbesondere in der Bauindustrie. Die wichtigsten Verwendungszwecke dieses Salzhydrats sind nachstehend aufgeführt:
- In der Bauindustrie wird Gips für Ausbauelemente verwendet. Er ist einer der Bestandteile von losen Zwischenprodukten, Mörteln, Klebstoffen, Gipsglättungen und fertigen Bauteilen, z. B. Gipskartonplatten.
- Die Medizin verwendet Gips, um gebrochene Gliedmaßen zu versteifen. Gipsbinden gelten als hautfreundlich. Darüber hinaus wird das Material auch in zahntechnischen Labors eingesetzt.
- Die Industrie verwendet Gips in Modellbau- und Konstruktionswerkstätten. Gipsabgüsse eignen sich sehr gut für die Formgebung verschiedener Gebrauchsgegenstände.
- Gips ist ein Zusatzstoff für einige in der Landwirtschaft verwendete Düngemittel.

Methan-Clathrate
Methanclathrate gehören zu einer Gruppe von Verbindungen, die als Gasohydrate bezeichnet werden. Sie sind für den größten Teil des raschen Klimawandels in der Erdgeschichte verantwortlich. Methanclathrate werden oft auch als Methanhydrate, Methanhydrate oder Methaneis bezeichnet. Sie bilden eine feste Form aus Wasser und Methan. Ihre Moleküle zeichnen sich durch ihre kristalline Struktur aus. Sie werden unter erhöhtem Druck gebildet. Sie haben die Form von weißen, geruchlosen Feststoffen, die äußerlich oft mit Eis verglichen werden. Interessant ist, dass sie sich ähnlich wie Styropor anfühlen. Clathrate sind einzigartige chemische Gruppierungen. Die Wassermoleküle bilden eine Struktur, die einem Käfig ähnelt. In diesem Käfig wird Methan gespeichert. Wichtig ist, dass die beiden Stoffe keine chemischen Bindungen miteinander eingehen. Normalerweise bestehen Methanclathrate aus 46 Wassermolekülen, die zwei kleine und sechs mittelgroße Käfige umgeben. In ihnen sind Methanmoleküle gefangen. Es ist auch bekannt, dass Clathrate aus 136 Wassermolekülen mit 16 kleinen und acht großen Käfigen aus Methangas im Inneren bestehen.
In den letzten Jahren wurden erhebliche Mengen dieser Ressource auf dem Grund der Ozeane entdeckt. Sie stößt auf großes Interesse, da sie die Möglichkeit bietet, erhebliche Mengen an Methan zu gewinnen, das z. B. für Energiezwecke genutzt werden kann. Methanclathrate brennen mit einer gleichmäßigen, rötlichen Flamme. Nach der Verbrennung bleibt geschmolzenes Wasser zurück. Das auf diese Weise gewonnene Methan ist zwar eine gute Alternative zu den herkömmlichen Kohlenwasserstoffquellen, stellt aber auch eine ziemliche Bedrohung für das Klima dar. Das Wissen über die Nutzung von Methan aus Clathraten, die sich am Meeresboden angesammelt haben, ist noch unzureichend. Die unkontrollierte Freisetzung erheblicher Mengen dieses Gases kann sehr gefährlich sein, da es den Treibhauseffekt viel stärker verstärkt als Kohlendioxid.























































































































