Das ist eine Gruppe anorganischer Verbindungen, die aus der Verbindung verschiedener Elemente mit Sauerstoff entstehen, mit der allgemeinen Formel XnOm, wobei "X" für ein beliebiges Element steht, "O" für Sauerstoff, immer in der zweiten Oxidationsstufe, und die Buchstaben "n,m" in der Tiefstellung Koeffizienten sind. Beispiele für Oxide sind Wasser H2O, Kaliumoxid K2O, Aluminiumoxid Al2O3, Calciumoxid CaO und Kohlenstoff(II)-oxid CO.

Einteilung der Oxide
Oxide können in mehrere Kategorien eingeteilt werden. Die allgemeinste Einteilung ist die Unterscheidung zwischen Metalloxiden, z. B. Lithium, Magnesium, Aluminium, Eisen, und Nichtmetalloxiden wie Kohlenstoff-, Stickstoff-, Schwefel- und Chloroxiden. Ein weiteres Kriterium ist die Unterscheidung nach ihrem Aggregatzustand. Bei den festen Stoffen handelt es sich fast ausschließlich um Metalloxide und einige Nichtmetalle (SiO2, P4O10), bei den flüssigen Stoffen um Wasser, Schwefel(VI)-Oxid und Mangan(VII)-Oxid und bei den gasförmigen Oxiden hauptsächlich um Nichtmetalle wie CO, CO2, SO2, NO und NO2. Wir können Oxide auch nach der Art der in ihnen vorhandenen Bindungen unterteilen. In Magnesiumoxid MgO, Kalziumoxid CaO oder Natriumoxid Na2O gibt es O2- Ionen und ionische Bindungen, daher der Name – ionische Oxide. Eine weitere Gruppe sind die kovalenten Oxide, z.B. Kohlenstoff(II)-oxid CO, Stickstoff(II)-oxid NO oder Schwefel(IV)-oxid SO2, bei denen die Bindung zwischen dem Sauerstoffatom und dem Element die Form einer polarisierten kovalenten Bindung hat.
Chemischer Charakter der Oxide
Die für Chemiker interessanteste Einteilung ist die nach der chemischen Natur der Oxide. Es gibt vier Hauptkategorien – saure, basische, neutrale und amphotere Oxide.
- Säureoxide, manchmal auch Säureanhydride genannt, zeichnen sich dadurch aus, dass sie mit Basen zu einem Salzprodukt reagieren. Ein beträchtlicher Teil der Säureoxide bildet, wenn sie in Wasser gelöst sind, entsprechende Lösungen von Sauerstoffsäuren. Dies geschieht u.a. mit Schwefel(IV)-oxid, das in Wasser gelöst Schwefel(IV)-säure bildet, und mit Chrom(VI)-oxid, das zu Chrom(VI)-säure gelöst wird:
SO2 + H2O → H2SO3
CrO3 + H2O → H2CrO4
Es gibt eine kleine Gruppe von Säureoxiden, die in Wasser unlöslich sind. Sie sind jedoch in Lösungen von starken Basen löslich. Dazu gehören Silicium(IV)-oxid SiO2, Molybdän(VI)-oxid MoO3 und Wolfram(VI)-oxid WO3. Ihre Reaktionen mit Basen bestätigen ihre saure Natur:
SiO2 + 2NaOH → Na2SiO3 + H2O
MoO3 + 2KOH → K2MoO4 + H2O
WO3 + 2NaOH → Na2WO4 + H2O
Säureoxide sind in der Regel Oxide von Nichtmetallen und Oxide von Metallen in ihrer höchstmöglichen Oxidationsstufe. Bildet ein Element mehrere Oxide in unterschiedlichen Oxidationsstufen, wie z.B. Chrom, so nehmen mit zunehmender Oxidationsstufe auch die sauren Eigenschaften der von ihm gebildeten Oxide zu:
- Chrom(II)-oxid CrO hat einen alkalischen Charakter,
- Chrom(III)-Oxid Cr2O3 hat einen amphoteren Charakter,
- Chrom(VI)-Oxid CrO3 hat einen sauren Charakter.

- Basische Oxide sind Verbindungen von Sauerstoff mit Metallen, die mit Säuren zu Produkten in Form der entsprechenden Salze reagieren. Einige von ihnen, d.h. Oxide, die mit Elementen der ersten und zweiten Gruppe des Periodensystems, mit Ausnahme von Beryllium, gebildet werden, zeichnen sich auch durch die Reaktion mit Wasser aus, die zur Bildung von basischen Hydroxiden führt. Dies ist zum Beispiel der Fall, wenn Natrium-, Lithium- und Bariumoxide mit Wasser reagieren:
Na2O + H2O → 2NaOH
Li2O + H2O → 2LiOH
BaO + H2O → Ba(OH)2
Es gibt auch basische Oxide, die sich nicht in Wasser, sondern nur in sauren Lösungen auflösen. Dazu gehören Mangan(II)-oxid und Eisen(II)-oxid:
MnO + H2SO4 → MnSO4 + H2O
FeO + 2HCl → FeCl2 + H2O
- Neutrale Oxide sind die am wenigsten reaktive Gruppe der Oxide. Sie reagieren weder mit Säuren noch mit Basen. Sie sind außerdem unlöslich in Wasser. Vertreter dieser Gruppe von Oxiden sind Kohlenstoff(II)-oxid CO und Stickstoff(II)-oxid NO.
- Amphotere Oxide sind das genaue Gegenteil der neutralen Oxide und weisen sowohl einen sauren als auch einen basischen Charakter auf. Das bedeutet, dass sie sowohl mit starken Basen als auch mit Säuren reagieren. Die Produkte solcher Reaktionen sind immer Salze, und das Element, das zunächst mit dem Sauerstoff verbunden ist, wird in das entsprechende Kation oder Anion des Säurerestes umgewandelt. Die einzige Gemeinsamkeit mit den neutralen Oxiden ist ihre schlechte Wasserlöslichkeit. Beispiele für amphotere Oxide sind Berylliumoxid BeO, Aluminiumoxid Al2O3, das bereits erwähnte Chrom(III)-oxid, Zinn(II)-oxid SnO, Blei(II)-oxid PbO und Zinkoxid ZnO. Bei der Reaktion mit wässrigen Lösungen starker Basen, zum Beispiel mit einer wässrigen Lösung von Natriumhydroxid, bilden sie komplexe Salze. In ihren Säureresten befinden sich die Atome oder Ionen des aus dem Oxid stammenden Metalls, die mit einer geeigneten Menge an Hydroxylgruppen komplexiert sind. Ihre Anzahl hängt von der Koordinationszahl ab, die das betreffende Element kennzeichnet. So haben beispielsweise Atome, die sich von Oxiden des MO-Typs (M – Metall) ableiten, wie z.B. Berylliumoxid BeO, eine Koordinationszahl von 4. Atome, die sich von Oxiden des M2O3-Typs ableiten, wie z.B. Al2O3, können zwei verschiedene Koordinationszahlen annehmen, je nach Reaktionsbedingungen 4 oder 6. Beispiele für Reaktionen von amphoteren Oxiden:
BeO + 2HCl → BeCl2 + H2O
BeO + 2NaOH + H2O → Na2[Be(OH)4] Natriumtetrahydroxycinnat
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2KOH + 3H2O → 2K[Al(OH)4] Kaliumtetrahydroxyaluminat
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6] Natriumhexahydroxyaluminat
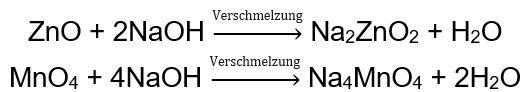
Einige Oxide, wie z.B. Zinkoxid und Mangan(IV)-oxid, weisen ganz spezifische amphotere Eigenschaften auf. Letzteres reagiert weder unter normalen noch unter Standardbedingungen mit irgendwelchen Basen. Beide hingegen reagieren mit ihnen durch Verschmelzung mit festen Basen, zum Beispiel:

Gewinnung von Oxiden
- Direkte Synthese von Elementen:
a) Synthese von Schwefel- und Sauerstoffatomen zu Schwefel(IV)-oxid
S + O → SO2
b) Synthese von Magnesium- und Sauerstoffatomen zu Magnesiumoxid
2Mg + O2 → 2MgO
c) Synthese von Kohlenstoff- und Sauerstoffatomen zu Kohlenstoff(IV)-oxid
C + O2 → CO2 - Thermische Zersetzung von Salzen, Hydroxiden und Oxiden:
a) Aufspaltung von Calciumcarbonat in Calciumoxid und Kohlenmonoxid (IV)
CaCO3 → CaO + CO2
b) Aufspaltung von Kupfer(II)-hydroxid in Kupfer(II)-oxid und Wasser
Cu(OH)2 → CuO + H2O
c) Aufspaltung von Mangan(IV)-oxid in Mangan(III)-oxid und Sauerstoff
4MnO2 → 2Mn2O3 + O2 - Oxidation von Oxiden auf niedrigeren Oxidationsstufen mit einer Erhöhung ihrer Wertigkeit:
a) Oxidation von Schwefel(IV)-oxid zu Schwefel(VI)-oxid
2SO2 + O2 → 2SO3
b) Oxidation von Stickstoffoxid (II) zu Stickstoffoxid (IV)
2NO + O2 → 2NO2
c) Oxidation von Kohlenmonoxid (II) zu Kohlenmonoxid (IV)
2CO + O2 → 2CO2
- Reduktion von Oxiden auf höheren Oxidationsstufen, mit einer Verringerung ihrer Wertigkeit:
a) Reduktion von Kohlenmonoxid (IV) zu Kohlenmonoxid (II)
CO2 + C → 2CO
b) Reduktion von Zinn(II)-oxid zu Zinn(I)-oxid
2SnO + O2 → 2SnO2 - Verbrennung von organischen Verbindungen
a) Verbrennung von Methan in Sauerstoff unter Bildung von Kohlenmonoxid (IV) und Wasser
CH4 + 2O2 → CO2 + 2H2O
b) Verbrennung von Ammoniak in Sauerstoff unter Bildung von Stickstoffoxid (II) und Wasser
4NH3 + 5O2 → 4NO + 6H2O - Reaktion von instabilen Sauerstoffsäuren:
a) Aufspaltung von Kohlensäure (IV) in Kohlenstoff(IV)-oxid und Wasser:
H2CO3 → CO2 + H2O
b) Aufspaltung von Schwefelsäure (IV) in Schwefeloxid (IV) und Wasser:
H2SO3 → SO2 + H2O