Die Bezeichnung pH-Puffer bezieht sich auf wässrige Lösungen, die trotz der Zugabe kleiner Mengen von Basen oder Säuren oder bei Verdünnung ihren pH-Wert nicht verändern. In der Praxis handelt es sich um Gemische aus Lösungen schwacher Säuren und ihrer Salze mit konjugierten starken Basen (Protonendonator-Protonenakzeptor) oder analog dazu Gemische aus Lösungen schwacher Basen und Salzen dieser Basen mit starken Säuren. Der Hauptzweck bei der Verwendung von Pufferlösungen ist ihre Rolle als Mittel, die es ermöglichen, den pH-Wert sehr stabil zu halten. Sie werden häufig in einer Vielzahl von chemischen Anwendungen verwendet, z.B. bei der Herstellung von Farbstoffen, bei Fermentationsprozessen und zur Bestimmung des pH-Werts von Lebensmitteln, Kosmetika und Arzneimitteln.
Henderson-Hasselbalch-Gleichung
Die grundlegende Abhängigkeit des pH-Wertes des Puffers von dem für die Säure bzw. Base verwendeten pKa bzw. pKb sowie das Verhältnis der Konzentrationen der Säure und der damit konjugierten Base bzw. umgekehrt der Base und der damit konjugierten Säure wird durch die Henderson-Hasselbach-Gleichung beschrieben. Sie zeigt die Korrelation zwischen der Stärke der verwendeten Säure und dem pH-Wert. Für eine Beispielreaktion eines Puffers, für die eine schwache Säure verwendet wurde, ist der Ablauf wie folgt:
HA + H2O ↔ H3O+ + A–
Die Korrelation zwischen [A–], also der molaren Konzentration der konjugierten Base [mol·dm-3], [HA], also der molaren Konzentration der undissoziierten Säure, und pKa, dem negativen Logarithmus der Gleichgewichtskonstante der Säuredissoziationsreaktion Ka, ausgedrückt durch die Henderson-Hasselbach-Gleichung für eine solche Reaktion, hat dagegen folgende Form:
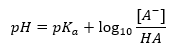
Henderson-Hasselbach-Gleichung für Acetatpuffer
Der Wirkungsmechanismus von Puffern beruht auf dem Vorhandensein von Ionen in ihnen, die die Fähigkeit haben, Wasserstoff- oder Hydroxid-Ionen zu binden. Bei der Betrachtung von Acetatpuffer, einem Gemisch aus Essigsäure und Natriumacetat, sollte eine Dissoziationsreaktion von schwacher Essigsäure und starkem Elektrolyten – Natriumacetat CH3COON geschrieben werden, der vollständig in Ionen dissoziiert ist.:
CH3COOH ↔ H+ + CH3COO–
CH3COONa → CH3COO– + Na+
Aufgrund dessen, dass die Pufferlösung ein Gemisch dieser Ionen ist, werden durch die Zugabe einer kleinen Menge starker Säure Ionen [H+] eingeführt, die sofort durch die Anionen CH3COO– an die Essigsäure gebunden werden, die unter diesen Bedingungen nicht dissoziiert wird. Dies führt also nicht zu einer Senkung des pH-Wertes. Ebenso führt die Zufuhr zusätzlicher Kationen OH- durch Einbringen einer starken Base in die Lösung nicht zu einer Erhöhung des pH-Werts. Sie werden sofort von Ionen H+, die aus der Dissoziation der Essigsäure stammen, in undissoziierte Wassermoleküle gebunden.
Die Gleichung, die die Dissoziationskonstante der Säure beschreibt, lautet:
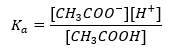
Bei der Dissoziation von schwacher Essigsäure wird die Gesamtkonzentration des Anions CH3COO– durch die Konzentration der Ionen aus der Dissoziation des Salzes bestimmt, die wiederum gleich der Konzentration des Salzes (cs), d.h. Natriumacetat, ist. Eine hohe Konzentration dieser Anionen führt dazu, dass die Konzentration der Kationen H+ abnimmt und somit der Grad der Säuredissoziation sinkt, so dass der Ka-Wert konstant bleibt. Aufgrund dieser Relation kann auch angenommen werden, dass die Anzahl der undissoziierten CH3COOH-Moleküle praktisch gleich der Gesamtkonzentration an Essigsäure (ck) ist. Daher ist es möglich, die Dissoziationskonstante in folgender Form zu schreiben:
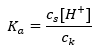
Nach Logarithmierung erhält man eine Relation, die zu der Henderson-Hasselbach-Gleichung führt:
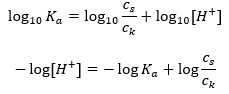
Daher hat die Henderson-Hasselbach-Gleichung die folgende Form:
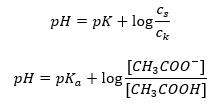
Wenn man die Relation zerlegt, ist der pKa-Wert in der Gleichung tatsächlich ein Maß für die Stärke der Säure. Werte von pKa kleiner als 3 (-log(0,001)) kennzeichnen hochpotente Säuren, je höher der Wert, desto geringer die Stärke der Säure. Eine aus der Henderson-Hasselbach-Gleichung abgeleitete Tatsache ist der äquivalente pH-Wert der Pufferlösung und der pKa-Wert der Säure, wenn das Verhältnis zwischen der Konzentration der undissoziierten Säure und der Konzentration des durch die Dissoziation der Säure gebildeten Anions gleich 1 ist, da log(1) gleich 0 ist.
Solche Bedingungen treten bei der Titration einer schwachen Säure mit einer starken Base auf, wenn eine solche Menge an Base hinzugefügt wird, die der Hälfte der Menge entspricht, die zur vollständigen Neutralisierung der Säure erforderlich ist. Der Titrationsgrad der Lösung beträgt dann 50 %. Je nach pH-Wert und der Menge des verwendeten Titriermittels ändert sich der pH-Wert im Pufferbereich relativ langsam.
Beispiel eines Ammoniumpuffers
Eine andere Art von Puffer ist der Ammoniumpuffer, der ein Gemisch aus der schwachen Base NH4OH und einem Salz der schwachen Base mit der starken Säure NH4Cl ist. Der Mechanismus ist jedoch sehr ähnlich. Das in dem Gemisch vorhandene Salz wird vollständig dissoziiert und seine Konstante ist die Gleichung:
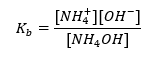
Im Gegensatz dazu ist die Ammoniumbase in einem starken Elektrolyten wie NH4Cl praktisch undissoziiert. Daher wird davon ausgegangen, dass die Konzentration des Kations NH4+ gleich der Konzentration des Salzes ist, während die Konzentration der undissoziierten NH4OH-Molekülen gleich der Konzentration der Base ist. Es ist also möglich, die Gleichung aufzustellen und den pH-Wert dieses Puffers zu berechnen.
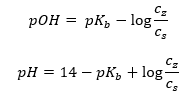
Die im Ammoniumpuffer vorhandenen Ionen NH4+, Cl– und NH4OH-Moleküle führen nach Zugabe einer Säure oder Base zu folgenden Reaktionen:
NH4OH + H+ ↔ NH4+ + H2O
NH4+ + OH– ↔ NH4OH
Wenn die Zugabe gering ist, ist die Änderung des Verhältnisses zwischen der Konzentration von Base und Salz und damit die Änderung des pH-Werts gering. Ändert sich das Verhältnis dieser Konzentrationen um das Zehnfache, so ändert sich der pH-Wert um eine Einheit.
Pufferkapazität
Mit dem Ausdruck Pufferkapazität wird die Fähigkeit einer Pufferlösung bestimmt, den Säuregrad der Lösung annähernd konstant zu halten. Genauer gesagt ist es die Anzahl der Grammäquivalente einer starken Säure oder einer starken Base, die bei Zugabe zu 1dm3 Pufferlösung deren pH-Wert um eine Einheit verändert. Die Formel, die die Pufferkapazität (β) definiert, beinhaltet ihre Abhängigkeit von der Anzahl der Mole der starken Säure/Base, die der Pufferlösung zugesetzt werden (Δn, [ml]), und die Änderung des pH-Werts, die beobachtet wird, wenn ein Volumen der starken Säure oder Base der Pufferlösung zugesetzt wird (ΔpH).
![]()
Dies ist ein Wert, der stark mit den Konzentrationen der Bestandteile verbunden ist und mit zunehmender Konzentration zunimmt. Der höchste Wert der Pufferkapazität ist für Pufferlösungen charakteristisch, deren pH-Wert gleich der Dissoziationskonstante der zu ihrer Herstellung verwendeten Säure pKa ist.
Das Funktionsprinzip des Phosphatpuffers
Eine weniger verbreitete Art von Puffern sind solche, deren Bestandteile zwei Wasserstoffsalze sind. In diesem Fall sind es zwei Wasserstoffsalze der Orthophosphorsäure (V), nämlich Natriumdihydrogenphosphat (V) und Natriumhydrogenorthophosphat (V). Im Gegensatz zu diesen gebräuchlichsten Puffern, die ebenfalls auf dem Prinzip der konjugierten Paare Säure-Base nach Brønsted beruhen, ist die Erkennung der Natur der Bestandteile nicht so offensichtlich. Da die im Phosphatpuffer vorhandenen Anionen spezifische Werte für Brønsted-Säure aufweisen, muss der Unterschied zwischen den beiden Werten genauer überprüft werden. Diesem Prinzip zufolge muss das Ion, das die stärkere Säure ist, einen höheren Wert der Dissoziationskonstante haben.
- Für H2PO4– Ka = 6,34·10-8
- Für HPO4-2 Ka = 4,36·10-13
Anhand dieser Daten kann man leicht zu dem Schluss kommen, dass in diesem Fall das Hydrogenanion H2PO4-13 die schwache Brønsted-Säure ist. Der Wirkungsmechanismus des Puffers beruht auf einem dynamischen Gleichgewicht, das sich mit folgender Gleichung beschreiben lässt:
![]()
Wenn der Pufferlösung kleine Mengen Säure zugesetzt werden, versucht das System, durch eine Reaktion, die die Wirkung der Kationen [H+] blockiert, eine entgegenwirkende Änderung des pH-Werts herbeizuführen, indem es das Hydrogenanion protoniert, wie in der folgenden Gleichung angegeben:
![]()
Die Tatsache, dass das Anion die zur Lösung hinzugefügten Puffer neutralisiert, ist darauf zurückzuführen, dass es die stärkere Brønsted-Base ist. Für solche Systeme gilt die Faustregel: Je stärker die Brønsted-Säure, desto schwächer die mit ihr konjugierte Base. Wird eine Säure in ein System eingeführt, das mehrere Brønsted-Basen enthält, reagiert die stärkste von ihnen zuerst.
Diese Beziehung ist die wichtigste Komponente bei der Betrachtung von Gleichgewichten in Gemischen von wässrigen Pufferlösungen, die aus einem Gemisch von Brønsted-Säuren und einem Gemisch von schwachen Brønsted-Basen bestehen. Das gleiche Prinzip sollte in der umgekehrten Situation befolgt werden, wenn eine Basenlösung in einen Phosphatpuffer eingebracht wird. Die Anionen OH–werden dann fast sofort von der stärkeren Brønsted-Säure im Puffer eingefangen. In diesem Fall ist es das Ion , und die Reaktion verläuft entsprechend der folgenden Gleichung:
![]()
Bekannte Puffer und ihre Anwendungsbereiche
- Blut wird bei 7,35 und 7,45 Einheiten gehalten, und seine Stabilität wird durch das Vorhandensein von Kohlensäure, hauptsächlich in Form von gelöstem Kohlendioxid und Ionen HCO3-, gewährleistet. Es ist ein Puffer vom Typ schwache Säure und ihr Salz, und eine plötzliche Zugabe von zu großen Mengen an Säuren oder Basen führt zu lebensbedrohlichen Zuständen. Ein ähnliches Beispiel für einen Puffer ist Speichel, der einen pH-Wert von etwa 7 hat.
- Ammoniumpuffer, Acetatpuffer, Boratphosphatpuffer, d.h. nacheinander:
- NH3 + NH4Cl pH = 8 – 11;
- CH3COOH + CH3COONa pH 3,5 – 6;
- K2HPO4 + KH2PO4 pH = 5,5 – 8;
- H3BO3 + Na2B4O7 pH = 7 – 9.
Alle gängigen Puffer werden überall dort eingesetzt, wo es wichtig ist, den pH-Wert konstant zu halten, darunter:
- in der Medizin, wo sie den Patienten in kritischem Zustand intravenös verabreicht werden;
- bei der Kultivierung von Mikroorganismen, wo der pH-Wert des Substrats ein wichtiger Faktor ist;
- bei der Arbeit mit Enzymen und Proteinen zur Stabilisierung der Umgebung, in der chemische Reaktionen ablaufen;
- in der Galvanotechnik werden sie in galvanischen Bädern eingesetzt, um schnelle, kritische Änderungen des pH-Wertes im Elektrodenraum zu verhindern;
- bei der Kalibrierung von pH-Messgeräten.