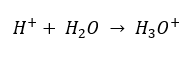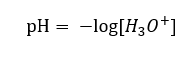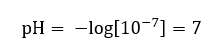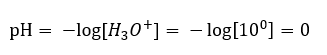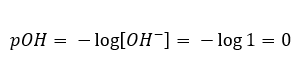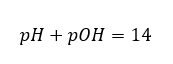In diesem Abschnitt finden Sie alle Informationen über chemische Grundlagen, aber auch Neuigkeiten aus der Welt der Chemie. Was ist das Periodensystem? Wer hat die radioaktiven Elemente entdeckt? Hier finden Sie die Antworten auf diese und viele andere Fragen!
Produkte
Chemische Rohstoffe
Kosmetik und Detergenzien
Agrochemikalien
Düngemittel und Pflanzenschutz
Empfohlene Produkte
Empfohlene INCI für landwirtschaftliche Anwendungen
Arzneimittelindustrie
Baustoffe und Bauwesen

Baukeramik

Baukleber

Beton- und Mörteladditive

Bohren und Tunnelbau

Draht- und Kabelisolierung

Dämmplatten

Gipskartonplatten und Gipsadditive

Holzindustrie

OCF (Einkomponentenschaum)

PU-Isoliersysteme

Rohr-in-Rohr-Isolierung

Rohrummantelungen

Sandwichplatten

Sonstige Anwendungen

Sprühsysteme für Wärme- und Schalldämmung

Straßenbau

Vorisolierte Rohre

chemische Anker
Beschichtungen und Tinten
Elektronik- und Elektroindustrie
Energie und Ressourcen
Klebstoffe und Dichtstoffe
Kunststoffe und Kautschuke
Lebensmittelindustrie
Möbelindustrie
Reinigung und Waschen
Schmierstoffe und Betriebsflüssigkeiten
Sprühdämmungen
Crossin®-Systeme
Textilien und Leder
Transport
Zellstoff- und Papierindustrie
Beispielhafte Produktfunktionen
INCI & CAS
Tenside
Polyurethane
Konsumgüter