Spektroskopische Methoden sind eine Gruppe von Verfahren, bei denen das erhaltene Signal durch die Wechselwirkung von elektromagnetischer oder korpuskularer Strahlung mit der zu untersuchenden Probe erzeugt wird. Eine solche Strahlung kann durch periodische Änderungen des elektromagnetischen Feldes entstehen, die mit der Energieübertragung verbunden sind. Diese Verfahren dienen der Bestimmung der Konzentration oder des Gehalts von Atomen in einem bestimmten absorbierenden oder emittierenden System. Welche Arten der Spektralphotometrie werden unterschieden und worin bestehen diese Verfahren? Dies erfahren Sie in unserem Artikel.

Strahlung und Energieübergänge
Die wichtigste Eigenschaft der Photonen – also der Strahlungsquanten – ist die Energie. Die Gleichung für den Energiewert (E) ist das Produkt aus der Planck-Konstante (h) von 6,626-10-34 [J-s] und der Sreahlungsfrequenz (v), ausgedrückt in Hertz [Hz].
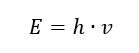
Die Spektralphotometrie nutzt Energieübergänge in Molekülen, die durch die Absorption oder Emission von elektromagnetischer Strahlung in verschiedenen Bereichen hervorgerufen werden:
- Ultraviolette Strahlung (UV) 200-380 nm,
- Sichtbare Strahlung (Vis) 380-780 nm,
- Infrarotstrahlung (IR) 0,78-30000 μm.
Grundbegriffe und Gesetze der Spektralphotometrie
Isosbestischer Punkt
Dies ist der Punkt, der einer bestimmten Wellenlänge entspricht, die sich aus dem Schnittpunkt der im Absorptions-Wellenlängen-System aufgezeichneten Kurven ergibt, wobei beide Formen der Verbindung in Lösung (dissoziiert und undissoziiert) die gleiche Absorption aufweisen. Eine Änderung des pH-Wertes ändert nichts an der Position, die Verbindung kann viele solcher Punkte haben.
Absorptionsspektrum einer chemischen Verbindung
Dieses Spektrum ist ein Maß für die Menge des von der Verbindung absorbierten Lichts bei Lichtwellenlänge (λ). Fällt elektromagnetische Strahlung (Licht) der Intensität I0 auf eine Probe, so wird ein Teil dieser Strahlung absorbiert und ein Teil geht durch die Probe hindurch. Durch Aufzeichnung der Intensitäten der einfallenden (I0) und der durchgelassenen(It) Strahlung lässt sich die Lichtmenge bestimmen, die von der Lösung absorbiert wird (Absorption, A) oder durch sie hindurchgegangen ist (Transmission, T).
Absorption
Die Größe, die das Phänomen der Absorption beschreibt, ist die Extinktion. Dies ist ein dimensionsloses Maß für die Intensität der elektromagnetischen Strahlung im Verhältnis zur Anzahl der freien Atome. Diese Zahl wurde eingeführt, um Berechnungen im Zusammenhang mit dem Absorptionsvolumen zu erleichtern. Als Absorption bezeichnet man die Wechselwirkung zwischen elektromagnetischer Strahlung und Materie – die Absorption eines Teils der Energie durch die Materie. Die Absorption ist additiv und wird bisweilen auch als optische Dichte bezeichnet. Als Symbol zur Bezeichnung dienen „Abs“ oder „A“. Mathematisch gesehen ist er der dezimale Logarithmus des Verhältnisses zwischen der Intensität des auf das Prüfmuster auftreffenden Strahlenbündels (I0) und der Intensität des durch das Prüfmuster hindurchgehenden Strahlenbündels(It). Sie kann Werte zwischen 0 und unendlich annehmen. Der mathematische Ausdruck, der diese Beziehung beschreibt, heißt Lambert-Beersches-Gesetz. Die Absorption bei einer bestimmten Wellenlänge hängt vom Absorptionskoeffizienten (ε), von der Dicke der absorbierenden Schicht (in der Regel 1 cm) und von der Konzentration der Testlösung ab.
Transmission
Der Transmissionsgrad ist das Verhältnis zwischen der Bestrahlungsstärke, die durch die Probe hindurchgeht(It), und der auf die Probe auftreffenden Bestrahlungsstärke (I0), die gleich der Bestrahlungsstärke ist, die durch die Referenz hindurchgeht. Sie wird meist als Prozentsatz ausgedrückt und kann zwischen 0% und 100% liegen. Sie wird durch folgende Formel ausgedrückt:
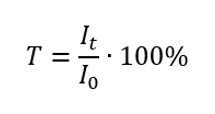
Das Verhältnis zwischen Absorptions- und Transmissionsgrad wird wie folgt ausgedrückt
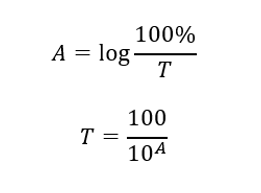
Lambertsches Gesetz
Dieses besagt, dass sich die Absorption proportional zu der Dicke der absorbierenden Schicht einer homogenen Probe verhält. Wir können sie als Quotient aus dem Absorptionskoeffizienten (k) und der Dicke der gemessenen Probenschicht (l) schreiben:
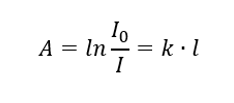

Lambert-Beersches Gesetz
Dieses betrifft die Absorption von Strahlung durch Lösungen und kann wie folgt formuliert werden: wenn der Absorptionskoeffizient des Lösungsmittels gleich Null ist, dann ist die Absorption eines monochromatischen Strahlenbündels, das eine homogene Lösung durchquert, direkt proportional zur Konzentration (c) der Lösung und zur Dicke der absorbierenden Schicht (l). Das Lambert-Beersche Gesetz ist die Definition der Absorption und kann wie folgt ausgedrückt werden:
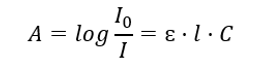
Der molare Absorptionskoeffizient (ɛ) ist ein charakteristischer Wert für einen Stoff in einem bestimmten Lösungsmittel und bei einer bestimmten Wellenlänge. Er ist proportional zu der Wahrscheinlichkeit von Übergängen zwischen den Energieniveaus des Moleküls und hängt direkt von der Energie der Strahlungsphotonen ab. Der Koeffizient stellt numerisch die Absorption einer Lösung mit einer Konzentration von 1 mol/dm3 und einer Absorptionsschichtdicke von 1 cm dar. Kennt man den Koeffizienten, ist es möglich, die Konzentration der Prüflösung zu bestimmen, nachdem man die Größe der Absorption gemessen hat. Optional kann aus dem Verhältnis und der Konzentration auch die zu erwartende Extinktion der Lösung berechnet werden. Die Formel wird hauptsächlich zur Bestimmung der Konzentration einer Substanz mit bekanntem molaren Absorptionskoeffizienten und empirisch gemessener Extinktion verwendet. Dies kann mit Hilfe einer Formel oder einer Kalibrierkurve geschehen, die für eine bestimmte Substanz an mehreren Punkten innerhalb des erwarteten Konzentrationsbereichs erstellt wird. Wir können das Lambert-Beersche Gesetz auch als Konzentrationsabhängigkeit der Absorption darstellen: A = f(C).
Gesetz der Additivität
Das Lambert-Beersche Gesetz bezieht sich auf den Fall, dass sich eine absorbierende Substanz in Lösung befindet. Sind jedoch in einer Mehrkomponentenlösung mehrere Stoffe enthalten, die die Strahlung bei einer bestimmten Wellenlänge absorbieren, so ist die Extinktion dieser Lösung (A) gleich der Summe der Extinktionen ihrer einzelnen Komponenten(A1,A2,…), d. h. A=A1+A2+⋯+An. Es sei daran erinnert, dass die Absorption eines jeden Bestandteils das Produkt aus seiner Konzentration und dem entsprechenden molaren Absorptionskoeffizienten ist. Dies ist das 3. Absorptionsgesetz, das bei der spektrophotometrischen Analyse von Mehrkomponentensystemen verwendet wird.
Ausnahmen von den Absorptionsgesetzen
Voraussetzung für die Einhaltung der Absorptionsgesetze ist, dass die auf das System einwirkende Strahlung monochromatisch und ihre Intensität nicht zu hoch ist. Die Gründe für ein Abweichen vom Lambert-Beerschen Gesetz können sein:
- Unzulänglichkeiten der Messgeräte, die dazu führen, dass die Bedingung nicht erfüllt wird;
- Chemische Reaktionen, die während der Messung stattfinden, z. B. Polymerisation, Hydrolyse, Kondensation;
- Trübung der Lösung.
Anwendung von Elektronenabsorptionsspektren
- Sie ermöglicht es, die Art der Elektronenübergänge durch Untersuchung der Spektren in Lösungsmitteln unterschiedlicher Polarität zu bestimmen.
- Die Unterschiede in der Position und Intensität der Absorptionsbänder der verschiedenen Molekülformen werden genutzt, um die Gleichgewichte zu untersuchen, die sich zwischen ihnen in Lösung einstellen (Strukturstudien, tautomere Gleichgewichte).
- Wird zur Bestimmung von Verbindungen auf der Grundlage des Lambert-Beerschen Gesetzes angewendet.
- Wird als zusätzliche Identifizierungsmethode auf der Grundlage der λmax-Position der Prüfsubstanzen genutzt.
- Sie werden bei der Bestimmung der Reinheit von Prüfsubstanzen verwendet – Verschiebung der Position des Absorptionsmaximums, Vergleich des Verhältnisses der Absorptionswerte an zwei verschiedenen Punkten des Spektrums.

UV-Vis-Elektronenspektroskopie
Für das Phänomen der Absorption ist die UV-Vis-Spektrophotometrie eine besonders interessante Technik, die eine qualitative und quantitative Analyse zahlreicher Substanzen ermöglicht. Das Phänomen der Strahlungsabsorption wird verwendet, wenn: die Absorption linear von der Konzentration abhängt oder wenn die Absorption additiv ist, d. h. bei einer Mehrkomponentenlösung die Summe der Absorptionen ihrer Komponenten ist. Die Bedingungen sind erfüllt, wenn es keine intermolekularen Wechselwirkungen im System gibt.
Durch die Analyse der UV-Vis-Absorptionsspektren, die sich aus der Transmission elektromagnetischer Strahlung durch die Lösung ergeben, werden Übergänge von Valenzelektronen vom Grundzustand in den angeregten Zustand beobachtet. Dieses Phänomen führt zu einer Absorption (Aufnahme) eines Teils der Strahlung bei bestimmten Wellenlängen. Die Absorption erfolgt durch den Übergang dieser Elektronen auf höhere Energieniveaus. Damit dies geschehen kann, müssen die Quanten der elektromagnetischen Strahlung genügend Energie aufweisen, um die Energiedifferenz zwischen den Energieniveaus auszugleichen. Bei Molekülen liegen diese Energien bei einigen Elektronenvolt, was genau der UV-Vis-Frequenz entspricht.
Chromophoren
Verbindungen, die eine Absorption im UV-Vis-Bereich zeigen, haben Chromophore in ihrer Struktur, d. h. Gruppen von Atomen, deren Elektronen durch niedrige Anregungsenergien gekennzeichnet sind. Mit anderen Worten: Ein Chromophor ist der Teil eines Moleküls (einer Gruppe von Atomen), der für die selektive Absorption von Strahlung im sichtbaren Bereich (180-800 nm) und damit für das Auftreten von Farbe verantwortlich ist. Dazu gehören: aromatische Ringe (aromatisches Elektronensextett), Mehrfachbindungen (teilweise π-Bindungen), sowohl zwischen Kohlenstoffatomen als auch zwischen anderen, wie der Carbonylgruppe C=O.
Auxochrome
Eine weitere Gruppe von Atomen sind Auxochrome, d. h. Substituenten, die keine Absorption im UV-Vis-Bereich zeigen, deren Vorhandensein jedoch Veränderungen in den Spektren der absorbierenden Elemente bewirkt. Sie verstärken die Wirkung der Chromophore, was sich oft in einer viel intensiveren Färbung der Prüfsubstanz zeigt als ohne sie. Darüber hinaus unterteilen wir die Auxochrome in Bathochrome, z. B. -NH2, -OH, die das Absorptionsmaximum zu längeren Wellenlängen verschieben, und Hypochrome, wie -CH3, -CO, die das Maximum zu kürzeren Wellenlängen verschieben.
Atomabsorptionsspektrometrie ASA
Dies ist eine weitere Technik, die das Phänomen der Absorption nutzt. Mit ihrer Hilfe werden chemische Elemente in Form von Proben in beliebigem Zustand (flüssig, fest, gasförmig) bestimmt. Die Messung selbst beruht auf der Beobachtung der Absorption von Strahlung einer bestimmten Wellenlänge durch freie Metallatome. Die Technik besteht darin, dass ein Atom nur elektromagnetische Strahlung bei einer Wellenlänge absorbieren kann, bei der es auch emittieren kann, und dies ist nur für das betreffende Element charakteristisch. Je mehr Energie dem Atom zugeführt wird, desto stärker werden die Elektronen zu höheren Niveaus angeregt und desto mehr Linien werden im Spektrum beobachtet. Entspricht die zugeführte Energie dem Ionisierungspotenzial des Atoms, bilden sich Ionen wie Na+. Die Grundlage für die quantitative Analyse mittels Atomabsorptionsspektrometrie ist die Proportionalität der Absorption zur Anzahl der absorbierenden Atome und das Lambert-Beer’sche Gesetz.