Die Stöchiometrie ist das Teilgebiet der allgemeinen Chemie, das sich mit Berechnungen zum quantitativen Ablauf chemischer Reaktionen befasst. Bei der Arbeit im Labor muss man wissen, wie viel (Masse, Volumen, Moleküle) von den Substraten verwendet wird, damit die chemische Reaktion, die man durchführt, vollständig abläuft oder um die vorausgesetzte Menge an Produkt zu erhalten. Manchmal ist es auch notwendig, die Über- oder Unterversorgung mit Substrat zu berechnen, die dazu geführt hat, dass das Experiment anders als erwartet verlaufen ist. Jede dieser Berechnungen ergibt sich direkt aus der quantitativen Interpretation der Notation einer chemischen Reaktionsgleichung und nutzt die Gesetze der Massenerhaltung. Diese Art von Gleichungen werden als stöchiometrische Berechnungen bezeichnet.

Was müssen wir wissen?
Um die Stöchiometrie anwenden zu können, sind Kenntnisse in einer Reihe von Bereichen erforderlich, darunter: chemische Reaktionsgleichungen, stöchiometrische Koeffizienten, Mol- und Molmassen sowie Molvolumina von Gasen und das Avogadrsche Gesetz. Mit dem Wissen über die Stöchiometrie chemischer Reaktionen können viele Rechenprobleme gelöst werden, beispielsweise:
- grundlegende Analysen,
- molare Berechnungen,
- Massenberechnungen,
- Berechnungen nicht stöchiometrischer Gemische mit der Möglichkeit, den limitierenden Stoff der Reaktion zu bestimmen,
- reaktionsfähigkeit.die R
Molare Masse
Aufgrund der unvorstellbar geringen Masse einzelner Atome und Moleküle wurde die Einheit (u), die die atomare Masse ausdrückt, geschaffen. In der Praxis ist dies ein Wert, der 1/12 der Masse des Kohlenstoffisotops 12Centspricht. Dieser Anteil einer Substanz steht in engem Zusammenhang mit der Avogadro-Konstante und wird als die Anzahl der Gramm einer Substanz bestimmt, die 6,022-1023 Atome, Moleküle oder Ionen enthält. Die molare Masse [M] ist numerisch gleich der atomaren oder molekularen Masse, die Einheit ist g/mol.
Molares Volumen des Stoffes [Vm]
Dies ist eine stoffspezifische Größe, die stark von den Temperatur- und Druckbedingungen abhängt. Dies ist das Volumen eines Stoffes, das von einem Mol des Stoffes eingenommen wird. Unter normalen Bedingungen wird ein konstanter Wert von 22,4 dm3 angenommen.
Gesetz der konstanten Zusammensetzung und der Erhaltung der Masse
Jede chemische Verbindung, unabhängig von ihrer Herkunft und der Art ihrer Gewinnung, hat eine genau definierte und konstante qualitative und quantitative Zusammensetzung. Schwefel(IV)-Oxid enthält zum Beispiel immer 50 Gew.-% Schwefel und Schwefel(VI)-Oxid 40 Gew.-% dieses Elements. In einem geschlossenen System ist die Masse der entstehenden Produkte gleich der Masse der während der Reaktion verbrauchten Substrate. Das Gesetz der Massenerhaltung spiegelt sich in der Notwendigkeit wider, jede chemische Reaktionsgleichung mit den entsprechenden chemischen Koeffizienten so auszugleichen, dass die beiden Seiten der Gleichung in Bezug auf die Anzahl der vorhandenen Atome gleich sind. Stöchiometrische Verhältnisse spiegeln die molaren Verhältnisse der in der betrachteten chemischen Reaktion vorhandenen Reaktanten wider.
Chemische Reaktionsgleichung
Alle erforderlichen Informationen über die relativen Beziehungen zwischen chemischen Stoffen werden aus ihrer chemischen Reaktionsgleichung abgeleitet. Daraus lassen sich einige wichtige relative und quantitative Informationen ablesen.
Beispiel 1.
Aus der Gleichung für die Synthese von Ammoniak, die gemäß der Reaktion erfolgt,
![]()
können wir mehrere Interpretationen vornehmen – molekular, molar, in molaren Massen, in molaren Volumina und in Molekülzahlen.
a) Auf molekularer Ebene können wir ablesen, dass drei Moleküle Wasserstoff mit einem Molekül Stickstoff zu zwei Molekülen Ammoniak reagieren.
b) Das bedeutet auch, dass drei Mol Wasserstoff mit einem Mol Stickstoff reagieren, um das Produkt aus zwei Mol Ammoniak zu bilden.
c) Anhand des Periodensystems der chemischen Elemente, das die Molmassen der einzelnen Atome enthält, kann man aus der Gleichung auch schließen, dass 6 g Wasserstoff mit 28 g Stickstoff vollständig zu 34 g Ammoniak reagiert haben.
d) Dann wissen wir unter normalen Bedingungen, dass ein Mol Gas 22,4 dm3 Daraus lässt sich schließen, dass 67,2 dm3 Wasserstoff mit 22,4 dm3 Stickstoff zu 44,8 dm3 Ammoniak reagieren.
e) Eine weitere nützliche Determinante ist das Avogadrosche Gesetz, das besagt, dass gleiche Volumina verschiedener Gase unter gleichen Druck- und Temperaturbedingungen die gleiche Anzahl von Teilchen enthalten. Da wir die Avogadro-Konstante von 6,022-1023 kennen, wissen wir, dass wir 3-6,022-1023 Wasserstoffmoleküle und 6,022-1023 Stickstoffmoleküle benötigen, um die vollständige chemische Reaktion zur Synthese von Ammoniak durchzuführen. Bei der Reaktion werden 2-6,022-1023 Ammoniakmoleküle gebildet.
Beispiel 2.
Die Verbrennungsreaktion von Magnesium in Chlor läuft nach der Gleichung ab:
![]()
Dies erlaubt es uns, ähnliche Interpretationen wie im vorherigen Beispiel vorzunehmen.
a) Schon auf den ersten Blick lässt die dargestellte Gleichung den Schluss zu, dass man zur Gewinnung eines Moleküls Magnesiumchlorid ein Molekül Magnesium und ein Molekül Chlor als Substrate bereitstellen muss.
b) Dies entspricht natürlich der Anzahl der im System vorhandenen Mole, d. h. ein Mol Magnesium, ein Mol Chlor, ein Mol Magnesiumchlorid.
c) Für die Berechnung der Masse wissen wir, dass 24 g Magnesium mit 71 g Chlor reagieren und 95 g Magnesiumchlorid bilden.
d) Da an der betrachteten chemischen Reaktion nur ein Gas, nämlich Chlor, beteiligt ist, kann man auch für dieses Gas schreiben, dass es ein Volumen von 22,4 dm3
e) Bei der Partikelanzahl ist jede Komponente gleich groß und nimmt den Wert 6.022-1023
Prozentuale Ausbeute der chemischen Reaktion [%W]
Stöchiometrische Berechnungen werden auch verwendet, um die Effizienz einer Reaktion zu ermitteln, d. h. das Verhältnis zwischen der tatsächlich erhaltenen Menge des Produkts und der aus der chemischen Reaktionsgleichung abgeleiteten Menge.
Beispiel 1.
Durchgeführt wurde die Oxidationsreaktion von 30 kg Schwefel(IV)-oxid. In Gegenwart eines Platinkatalysators erhielt man 34 kg Schwefel(VI)-oxid. Wie effizient verlief dieser Prozess?
Chemische Reaktionsgleichung:
![]()
Aus der aufgezeichneten Reaktion geht hervor, dass aus zwei Molen Schwefel(IV)-oxid die gleiche Menge an Molen Schwefel(VI)-oxid entsteht. Da wir die Molmassen der Reaktanten kennen, wissen wir, dass stöchiometrisch, unter der Annahme einer 100%igen Ausbeute, 128 g SO2 160 g SO3 ergeben. Somit können wir das Größenverhältnis festlegen:
0,128 kg SO2 – 0,160 kg SO3
30 kg SO2 – x kg SO3
Von hier aus wird die Menge an Schwefel(VI)-Oxid ermittelt, die bei einem 100-prozentigen Wirkungsgrad erzeugt werden würde.
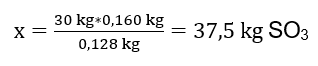
Wenn man die theoretische und die tatsächliche Menge an SO3 kennt, kann man die Ausbeute berechnen, bei der die gewünschte Reaktion stattgefunden hat.
37,5 kg SO3 – 100%ige Kapazität
34 kgSO3 – x% Effizienz
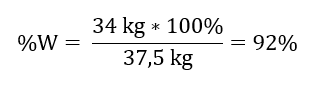
Die Oxidation von Schwefel(IV)-oxid zu Schwefel(VI)-oxid unter Verwendung eines Platinkatalysators erfolgte mit 92 % Effizienz.
Reelle und elementare Formeln
Eine weitere Anwendung stöchiometrischer Berechnungen ist die Bestimmung der Formeln einfacher chemischer Verbindungen. Die tatsächliche Formel ist die Summenformel einer chemischen Verbindung, die mit der Summenformel identisch oder ein ganzzahliges Vielfaches davon ist. Wenn man weiß, dass die allgemeine Formel einer chemischen Verbindung NxOy lautet, kann man die Werte der stöchiometrischen Indizes berechnen, indem man die Masse pro Atom durch ihre Atommassen teilt. Wenn das Molekulargewicht einer chemischen Verbindung nicht bekannt ist, sondern nur ihre prozentuale Zusammensetzung, kann nur die Elementarformel angegeben werden. Sie kann eine echte Darstellung der Summenformel sein oder lediglich das Verhältnis der einzelnen Elemente bestimmen.
Beispiel 1.
Die chemische Verbindung hat ein Molekulargewicht von 92 u und besteht aus 30,43 % Stickstoff und 69,57 % Sauerstoff. Wie lautet die tatsächliche Formel der betrachteten chemischen Verbindung?
Da die Summe der in der Verbindung vorhandenen Moleküle 100% beträgt, können wir davon ausgehen, dass:
92 u – 100%
Auf diese Weise lassen sich die einzelnen Elementgehalte berechnen:
92 u – 100%
x u von Stickstoff – 30.43%
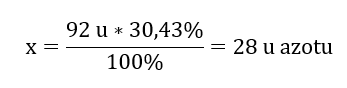
Daher wissen wir, dass die Masse pro Sauerstoffatom gleich ist:
92 u – 28 u = 64 u
Wenn man die Einzelmassen der Elemente kennt, kann man die stöchiometrischen Indizes bestimmen:
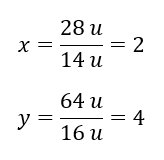
Die eigentliche Formel dieser chemischen Verbindung lautet N2O4.
Beispiel 2.
Die chemische Verbindung besteht aus zwei Elementen – Sauerstoff (60 %) und Schwefel (40 %). Wie lautet seine Grundformel?
Die allgemeine Formel lautet SxOy, wobei x für 40 % und y für 60 % steht. Bei Kenntnis der Molmassen der einzelnen Elemente kann dies wie folgt dargestellt werden:
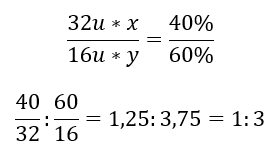
Das bedeutet, dass in einer bestimmten chemischen Verbindung drei Sauerstoffatome auf ein Schwefelatom kommen. Die elementare Formel lautet SO3.

Überschüssiges und begrenztes Substrat
Bei Reaktionen, bei denen die Reaktanten in einem von der Stöchiometrie abweichenden Verhältnis vorhanden sind, wird einer der Reaktanten vollständig überreagieren und die Reaktion wird abgebrochen. Er liegt dann in Form des limitierenden Reaktanten vor, während der zweite Reaktant im Überschuss im System vorhanden ist und auch nach Abschluss der Reaktion noch in seiner primären Form im System vorhanden sein wird.
Beispiel 1.
Im Labor wurden 40 cm3 einer 0,25 M Aluminiumsulfatlösung mit 50 cm3 einer 0,5 M Bariumchloridlösung zur Reaktion gebracht. Wie viel Gramm Niederschlag entstehen?
Chemische Reaktionsgleichung:
![]()
Der erste Schritt zur Ermittlung des tatsächlichen Verlaufs einer Reaktion besteht darin, die tatsächliche Molzahl der an der Reaktion beteiligten Stoffe zu bestimmen.
nAl2(SO4)2: C Al2 (SO4) 2 – V Al2(SO4)2 = 0,25 – 0,04 dm3 = 0,010 mol
nBaCl2: C BaCl2 – V BaCl2 = 0,5 – 0,05 dm3= 0,025 mol
Der zweite Schritt besteht darin, das in Untermenge vorhandene Substrat anhand der Stöchiometrie der Reaktion zu bestimmen. Dadurch wird die Menge des gebildeten Niederschlags bestimmt.
1Mol Al2(SO4)3 – 3Mol BaCl2
0,010 mol Al2(SO4)3 – x mol BaCl2
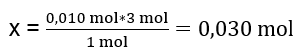
Um die Reaktion mit 0,010 mol Al2(SO4)3 vollständig durchzuführen, muss man dem System 0,030 mol BaCl2 hinzufügen. Bariumchlorid reagiert jedoch nur mit 0,025mol, was bedeutet, dass es knapp ist und die Reaktion einschränkt. Daher sollte die Menge des bei der Reaktion gebildeten Niederschlags anhand der Menge dieses Substrats berechnet werden.
Die Anzahl der Mole von Bariumchlorid, die gemäß der Stöchiometrie der Reaktion verwendet werden, ist gleich der Anzahl der Mole des gebildeten Niederschlags:
nBaSO4 = nBaCl2
0,025mol BaSO4 = 0,025mol BaCl2
Wenn man die Anzahl der Mole von Bariumsulfat kennt, kann man seine Masse berechnen:
mBaSO4 = nBaSO4 –MBaSO4
mBaSO4 = 0,025mol – 233,393 g/mol = 5,835g
Die in der Aufgabe angegebenen Reaktionen und Mengen an Substraten ergeben 5,835 g Bariumsulfatniederschlag.