Elektronegativität ist eine Größe, die die Tendenz eines bestimmten Atoms innerhalb eines Moleküls widerspiegelt, Elektronen an sich zu ziehen. In der Praxis ist es die Fähigkeit eines Atoms oder einer funktionellen Gruppe, die Elektronendichte zueinander anzuziehen. Die am häufigsten verwendete Skala im Zusammenhang mit dieser Größe ist die von Linus Pauling eingeführte Skala, mit der sich die ungefähre Art der Bindung leicht berechnen lässt.

Merkmale von Elektronegativität
Homonukleare Moleküle, zum BeispielH2 und O2, haben die gleichen Koeffizienten cA und cB in ihren Molekülorbitalen, die mit Wellenfunktionen beschrieben werden können:
Ψ+AB = cAΨA + cBΨB
Ψ−AB = cAΨA − cBΨB
In diesem Fall ist das Orbital dadurch gekennzeichnet, dass sich seine Form symmetrisch zum Zentrum des Moleküls befindet und seine elektrische Ladung gleichmäßig symmetrisch darin verteilt ist. Ein weiteres Beispiel sind heteronukleare Moleküle, bei denen es praktisch unmöglich ist, gleiche Koeffizienten sowie ihre vollständige Symmetrie in Bezug auf das Zentrum des Moleküls zu erhalten. Wenn das Energieniveau des AtomorbitalsΨB niedriger ist als das Energieniveau des AtomorbitalsΨA, tritt die Beziehung , und das Maximum der Wahrscheinlichkeitsdichte der Elektronenbegegnung verschiebt sich in Richtung Atom B. In der Praxis führt dies zu einer Verschiebung des in der chemischen Bindung geteilten Elektronenpaares, d.h. zu einer Polarisierung in Richtung des B-Atoms. Beim Lithiumhydridmolekül LiH beispielsweise erfolgt diese Verschiebung in Richtung des Wasserstoffatoms, während sie beim Fluorwasserstoffmolekül HF in Richtung des Fluoratoms erfolgt. Das bedeutet, dass das Wasserstoffatom ein niedrigeres Energieniveau als Lithium, aber ein höheres Energieniveau als Fluor besitzt. Unter diesen Bedingungen ist eines der Atome der beiden Moleküle negativ geladen (-δ) und das andere positiv (+δ). Die allgemeine Formel eines solchen Moleküls lautet A+δB-δ.
Ladungen der Atome
Die vorgenannte Ladung δ kann je nach den durch die chemische Bindung gebundenen Elementen unterschiedliche Werte annehmen. Sein Wert von 0 bedeutet, dass das Elektronenpaar seine Ladung symmetrisch verteilt und sich vollständig in der Nähe eines Atoms mit einem niedrigeren Energieniveau befindet, was zur Übertragung beider Elektronen auf dieses Atom führt. Dadurch entsteht eine ionische Bindung zwischen den Elementen. In der überwiegenden Mehrheit der chemischen Bindungen gibt es jedoch Bruchteile von Ladungen, so dass zwischen kovalenter und ionischer Bindung unterschieden wird.
Dipolmoment
Ein Dipol ist ein Molekül, in dem zwei Pole – positiv und negativ – unterschieden werden können. Das Dipolmoment, bezeichnet mit μ, ist dagegen ein Maß für die Größe der elektrischen Ladungsverschiebung in ihm. Sie ist definiert als das Produkt aus dem Absolutwert der elektrischen Ladung (δ), die in einem der Pole enthalten ist, und der Entfernung von diesen Polen (l):
μ = δ – l
Wir bezeichnen eine positive Ladung (δ+) und eine negative Ladung (δ-) als Teilladung und ordnen sie einem bestimmten Atom zu, in Wirklichkeit jedoch handelt es sich nur um die größere oder geringere Wahrscheinlichkeit, dass sich ein Elektron in der Nähe des Kerns befindet. Dieses Phänomen wird manchmal mit den Prozessen der Oxidation und Reduktion verwechselt, aber im Gegensatz zu den dort stattfindenden Veränderungen führt die Aufnahme solcher Ladungen durch die Atome nicht dazu, dass sie in eine andere Oxidationsstufe übergehen, es findet also kein Elektronenaustausch zwischen ihnen statt. Die SI-Einheit zur Angabe des Dipolmoments ist das Coulombmeter (C-m). Die im CGS-System geschriebene Einheit, der Debye (D), wird jedoch am häufigsten für Berechnungen verwendet. Ein Debye entspricht einem Wert von 3,33564-10-30 C-m. Das größte theoretisch mögliche Dipolmoment kennzeichnet Moleküle mit einer rein ionischen Bindung. Am kleinsten ist das Dipolmoment dagegen bei Molekülen, deren Bindung rein kovalent ist – in diesem Fall ist das Dipolmoment null. Bei den meisten handelt es sich jedoch um Zwischenfälle mit unterschiedlichen Partikelcharakteren.
Dipolmoment von Fluorkohlenwasserstoffen
Mehrere Beziehungen zwischen der Elektronegativität und dem Dipolmoment lassen sich leicht an bestimmten chemischen Verbindungen beobachten.
Tabelle 1 Dipolmomente von Fluorkohlenwasserstoffen
| Verbindung | Experimentell bestimmtes Dipolmoment [μ, D] | Bindungslänge [pm] | Das Produkt aus Elementarladung und Dipollänge [e-l, D] | Anteil des ionischen Charakters [%] | Unterschiedliche Elektronegativität von Fluor und Wasserstoff |
| HF | 1,98 | 92 | 4,42 | 45 | 1,9 |
| HCl | 1,08 | 128 | 6,15 | 18 | 0,9 |
| HBr | 0,79 | 143 | 6,87 | 12 | 0,7 |
| HI | 0,38 | 162 | 7,78 | 5 | 0,4 |
Das Verhältnis μ/(e-l‘), d. h. das tatsächliche Dipolmoment zu dem Dipolmoment, das einer Ionenbindung entspricht, kann ein Maß für Abweichungen von der vollständig kovalenten Natur der Bindung sein. Das Produkt dieser Beziehung in der Form (μ/(e-l‘))-100% gibt den prozentualen Anteil des ionischen Charakters der betrachteten Bindung an. Dies ist nur ein Näherungswert, da das Dipolmoment nicht nur von der Polarität der Bindung, sondern auch vom Verhalten der freien Elektronenpaare abhängt. Es kommt vor, dass die Elektronenwolke an die Außenseite des Moleküls verschoben werden kann, was zur Folge hat, dass die Gleichung zur Bestimmung des Dipolmoments einen zusätzlichen Term enthält. Im Falle des Ammoniakmoleküls richtet sich die Wolke nach dem Dipolmoment der Bindung, was zu einer Erhöhung des resultierenden Dipolmoments führt. Für das Kohlenmonoxidmolekül hingegen gilt das Gegenteil: Die Wolke ist in die entgegengesetzte Richtung gerichtet und verringert folglich das resultierende Dipolmoment.

Elektronegativität
Hierbei handelt es sich um eine dimensionslose empirische Größe, die Tendenz eines bestimmten Atoms innerhalb eines Moleküls widerspiegelt, Elektronen an sich zu ziehen. Und in der Praxis ist es die Fähigkeit eines Atoms oder einer funktionellen Gruppe, die Elektronendichte zueinander anzuziehen. Die am häufigsten verwendete Skala im Zusammenhang mit dieser Größe ist die von Linus Pauling eingeführte Skala, mit der sich die ungefähre Art der Bindung leicht berechnen lässt. Der Wissenschaftler wandte die folgende Methode an, um die Elektronegativität der einzelnen Elemente zu berechnen:
Wir nehmen an, dassDA-A undDB-B die Bindungsenergien der zweiatomigen Moleküle(A2, B2) sind. Wir bezeichnen die Bindungsenergie, die im Molekül auftritt, als DA-B. Empirisch hat sich gezeigt, dass die Differenz zwischen den Werten DA-B und dem geometrischen Mittel derDA-A- undDB-B-Energiewerte gleich oder nahe Null ist, wenn eine solche Bindung wenig oder keinen ionischen Charakter aufweist. Wenn die A-B-Bindung deutliche Abweichungen vom kovalenten Charakter aufweist, nimmt diese Differenz positive Werte an, die mit zunehmendem Anteil des ionischen Charakters ansteigen. Die Differenz zwischen der Elektronegativität (x) der beiden an der Bindung beteiligten Atome wird durch die Formel ausgedrückt:
![]()
Wenn Pauling bei seinen Berechnungen von einer Elektronegativität des Fluors von 4,0 ausgegangen ist, lassen sich also die nachfolgenden Elektronegativitäten der Elemente berechnen. Wenn wir den Wert xA der Atome des Elements A und den Wert des Koeffizienten Δ‘ kennen, können wir den WertxB anhand der obigen Gleichung berechnen. Die Pauling-Skala ist so aufgebaut, dass ihre Werte annähernd mit den Werten des Dipolmoments der von den betrachteten Atomen gebildeten Bindung übereinstimmen, wie das Beispiel in Tabelle 1 zeigt, das die für die Halogene ermittelten Werte enthält. Neben der oben erwähnten Skala gibt es noch weitere, die in der wissenschaftlichen Literatur aufgeführt sind, wie z.B. die Elektronegativität, beschrieben von:
- Mulliken, dessen Arbeit davon ausging, dass die Elektronegativität eines Elements direkt proportional zur Summe seiner Elektronenaffinität und Ionisierungsenergie ist. Die Elektronenaffinität, d.h. die Menge an Energie, die durch die Bindung eines Elektrons an ein neutrales Atom freigesetzt wird und die Ionisierungsenergie entspricht der Menge an Energie, die erforderlich ist, um ein Elektron von einem neutralen Atom zu lösen. Die höchsten Elektronegativitäten sind daher durch Atome mit hoher Elektronenaffinität und hoher Ionisierungsenergie gekennzeichnet.
- Allred und Rochow, die die Proportionalität der Elektrosensibilität zum Maß der Kraft annahmen, mit der der Atomkern (Z) auf die Valenzelektronen wirkt, in der Form
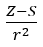 (r – Atomradius, S – Schirmkonstante) . Nach ihrer Theorie kann die Elektronegativität (x) der Elemente mit Hilfe der Formel berechnet werden:
(r – Atomradius, S – Schirmkonstante) . Nach ihrer Theorie kann die Elektronegativität (x) der Elemente mit Hilfe der Formel berechnet werden:
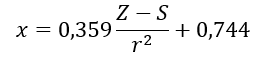
Auf jeder Skala liegt die Elektronegativität von Wasserstoff nahe dem Wert 2,2, wobei die anderen Werte leicht variieren. Beispiele für die nach der Pauling-, Mulliken-, Allred- und Rochow-Skala berechneten Elektrnegativitäten von Elementaratomen sind in Tabelle 2 aufgeführt.
Tabelle 2 Elektronegativitäten von Beispielelementen auf der Pauling- (P), Mulliken- (M) und Allred- und Rochow-Skala (AR)
| Atom | P | M | AR |
| F | 3,98 | 3,90 | 4,10 |
| O | 3,44 | 3,0 | 3,50 |
| N | 3,04 | 2,28 | 3,07 |
| Cl | 3,16 | 2,95 | 2,83 |
| C | 2,55 | 1,75 | 2,50 |
| H | 2,20 | 2,21 | 2,20 |
| Si | 1,90 | 2,25 | 1,74 |
| K | 0,82 | 0,77 | 0,91 |
| Rb | 0,82 | 0,50 | 0,89 |
| Cs | 0,79 | – | 0,86 |
| Fr | 0,70 | – | 0,86 |
Trotz der Diskrepanzen in den Berechnungen der drei Methoden hat Fluor in jedem Maßstab die höchste Elektronegativität, gefolgt von Sauerstoff, Stickstoff und Chlor. Die geringsten Werte wurden für Francium, Cäsium, Rubidium und Kalium ermittelt. Elemente, die typischerweise Nichtmetalle sind, haben Elektronegativitäten über dem Wert 2, typische Metalle haben Elektronegativitäten unter 2. Der Standardwert ist die bereits erwähnte Elektronegativität von Wasserstoff von etwa 2,2.

Elektronegativität im Periodensystem
Wie viele andere Eigenschaften spiegelt sich die Elektronegativität auch in der Anordnung der chemischen Elemente im Periodensystem wider. In der Gruppe nimmt die Elektronegativität mit zunehmender Anzahl von Beschichtungen und metallischem Charakter ab, d.h. sie steigt in Richtung von Frans zu Wasserstoff. Im Laufe der Zeit nimmt die Elektronegativität mit einer Zunahme der vorhandenen Valenzelektronen und einer Abnahme des nichtmetallischen Charakters zu, also von Metallen zu Edelgasen.
Elektronegativität und Bindungstyp – Zusammenfassung
Wenn man die einzelnen Werte der Elektronegativität der Elemente kennt, die eine chemische Bindung eingehen, kann man auf deren Art schließen. Liegt die Differenz zwischen 0,0 und 0,4, handelt es sich um eine kovalente Bindung. Liegt diese Differenz zwischen 0,4 und 1,7, handelt es sich um eine polarisierte kovalente Bindung. Ab einem Wert von 1,7 für den Unterschied in der Elektronegativität der Elemente kann man davon ausgehen, dass es zu einer ionischen Bindung kommt.