En cuanto a su estructura, los ácidos carboxílicos son compuestos orgánicos importantes y son derivados de acilo. Son un tipo de materiales de construcción para muchos derivados, incluidos ésteres y amidas. En la naturaleza podemos encontrar toda una gama de diversos ácidos carboxílicos, como el ácido acético CH 3 COOH, que es el compuesto básico del vinagre de mesa, el ácido butírico CH 3 CH 2 CH 2 COOH responsable del olor a mantequilla rancia, o más ácido cólico complejo, que es el componente básico de los jugos biliares humanos.

La fórmula general de los ácidos carboxílicos es:
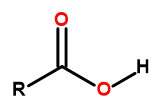
Figura 1 La fórmula general de los ácidos carboxílicos es:
Nomenclatura de ácidos carboxílicos
De acuerdo con el sistema de nomenclatura de la IUPAC, los ácidos carboxílicos se pueden nombrar de dos formas, según el tamaño y la complejidad de la molécula. Los ácidos que son derivados alifáticos se nombran sistemáticamente cambiando la terminación alcano de -ano a -oico y agregando la palabra inicial "ácido", por ejemplo, ácido propanoico, ácido butanoico, ácido 3-etil-6-metiloctanodioico. La numeración de los átomos de carbono en tales compuestos químicos siempre comienza con el átomo en el grupo funcional –COOH. El segundo sistema de denominación, especialmente útil para los ácidos en los que el grupo carboxilo está unido al anillo, permite agregar las palabras "ácido" antes y "carboxílico" después del nombre sistemático del compuesto. En tales casos, la numeración de los átomos de carbono comienza con el átomo al que está unido el grupo carboxilo, que a su vez se trata como un sustituyente.
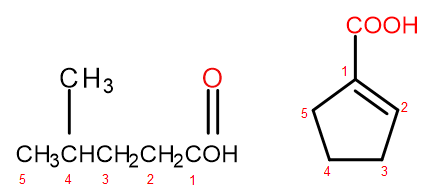
Figura 2 Numeración de los átomos de carbono en, de izquierda a derecha: ácido 4-metilpentanoico, ácido 1-ciclopentenocarboxílico.
| Ácido carboxílico | grupo acilo | ||
| Estructura | Nombre | Estructura | Nombre |
| HCOOH | Fórmico | HCO- | formilo- |
| CH3COOH | Acético | CH 3 CO- | Acetilo- |
| CH 3 CH 2 CH 2 COOH | butírico | CH 3 CH 2 CH 2 CO- | butirilo- |
| HOOOCCOOH | Oxálico | -OCCO- | Oxalil- |
| HOOC(CH 2 ) 2 COOH | succínico | -OC( CH2 ) 2CO- | Succinil- |
La estructura y propiedades físicas de los ácidos carboxílicos.
La similitud del grupo carboxilo con las cetonas y los alcoholes puede sugerir propiedades físicas similares. Como en las cetonas, el átomo de carbono del grupo funcional tiene una hibridación sp 2 . Esto está directamente relacionado con su estructura plana y ángulos de alrededor de 120 o entre los enlaces CCO y OCO. Por ejemplo, el ácido acético CH 3 COOH tiene ángulos de enlace iguales a:
- 119 o para CC=O,
- 119 o para CC-OH,
- 122 o para O=C-OH.
Las longitudes de enlace son las siguientes:
- 52Å para CC,
- 25Å para C=O,
- 31Å para C-OH.
Los ácidos carboxílicos muestran su similitud con los alcoholes debido a su fuerte asociatividad provocada por la posibilidad de formar enlaces de hidrógeno. En la práctica, la mayoría de estos compuestos existen como dímeros cíclicos cuya estructura se mantiene mediante la formación de enlaces de hidrógeno. Este sistema específico de enlaces de hidrógeno también afecta los puntos de ebullición de los ácidos carboxílicos. Provoca su aumento significativo en comparación con los alcoholes correspondientes. Por ejemplo, las constantes físicas: el punto de fusión y el punto de ebullición en grados Celsius son respectivamente:
- ácido fórmico : 8,4; 100.7,
- ácido acético: 16,6; 117.9,
- ácido propanoico: -20,8; 141,
- ácido benzoico: 122,1; 249.
Disociación de ácidos carboxílicos
Las propiedades ácidas de este grupo de compuestos les permiten reaccionar con bases, incluidos el hidróxido de sodio y el bicarbonato de potasio. Los productos de tales reacciones son sales de ácidos carboxílicos. La solubilidad de los ácidos carboxílicos en agua es despreciable, pero sus sales con metales alcalinos, debido a su estructura iónica, se disuelven muy bien en agua. Estos compuestos, que son ácidos en la teoría de Bronsted-Lowry, se disocian en soluciones acuosas diluidas. Como resultado de la transformación, se forman el anión carboxilato RCOO – y el catión hidronio H 3 O + .
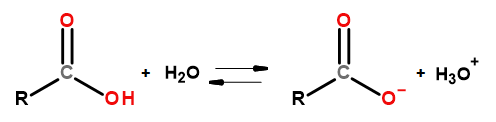
Figura 3Esquema de disociación de ácidos carboxílicos.
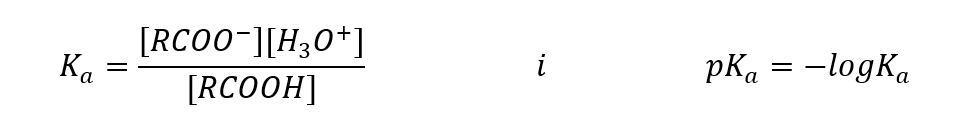 Los valores determinados empíricamente para los ácidos carboxílicos muestran que son compuestos débilmente disociados, por lo que en la práctica también son ácidos débiles. Para la mayoría de ellos, la constante Ka toma un valor de alrededor de 10 -5 . Para el ácido acético K a = 1,76 · 10 -5 , que, después de la conversión, da el valor de pK igual a 4,75. Esto equivale a la disociación de solo alrededor del 0,1 %de las moléculas, lo que, en comparación con ácidos inorgánicos fuertes con un grado de disociación del 100 %, confirma que se trata de ácidos de baja resistencia. En comparación con los alcoholes, cuyas constantes de equilibrio oscilan en el orden de magnitud 10 -16 , los ácidos carboxílicos son mucho más fuertes. A pesar de su similitud estructural, este hecho se debe a la estabilidad del anión carboxilato con respecto al anión alcóxido. Tenga en cuenta que la carga negativa en los alcóxidos está en un solo átomo de oxígeno, que es altamente electronegativo. En cambio, en los aniones carboxilato, la carga está deslocalizada entre los dos oxígenos del grupo funcional. Esto lo hace más estable en comparación con el anión producido por los alcoholes.
Los valores determinados empíricamente para los ácidos carboxílicos muestran que son compuestos débilmente disociados, por lo que en la práctica también son ácidos débiles. Para la mayoría de ellos, la constante Ka toma un valor de alrededor de 10 -5 . Para el ácido acético K a = 1,76 · 10 -5 , que, después de la conversión, da el valor de pK igual a 4,75. Esto equivale a la disociación de solo alrededor del 0,1 %de las moléculas, lo que, en comparación con ácidos inorgánicos fuertes con un grado de disociación del 100 %, confirma que se trata de ácidos de baja resistencia. En comparación con los alcoholes, cuyas constantes de equilibrio oscilan en el orden de magnitud 10 -16 , los ácidos carboxílicos son mucho más fuertes. A pesar de su similitud estructural, este hecho se debe a la estabilidad del anión carboxilato con respecto al anión alcóxido. Tenga en cuenta que la carga negativa en los alcóxidos está en un solo átomo de oxígeno, que es altamente electronegativo. En cambio, en los aniones carboxilato, la carga está deslocalizada entre los dos oxígenos del grupo funcional. Esto lo hace más estable en comparación con el anión producido por los alcoholes.
Obtención de ácidos carboxílicos
- Oxidación de alquilbencenos sustituidos con KMnO 4 o Na 2 Cr 2 O 7 con el producto en forma de ácidos benzoicos sustituidos. Es posible oxidar grupos alquilo primarios y secundarios,
- Oxidación del enlace C=C en alquenos con al menos un átomo de hidrógeno de vinilo usando KMnO 4 ,
- Oxidación de alcoholes primarios y aldehídos. Alcoholes usando el reactivo de Jones, aldehídos usando el mismo reactivo y óxido de plata básico,
- Hidrólisis de nitrilos bajo la influencia de soluciones fuertes y calientes de ácidos o bases,
- La reacción de los compuestos de Grignard con dióxido de carbono, con un producto intermedio en forma de carboxilato de magnesio. El compuesto de transición luego reacciona con el ácido.
Reacciones de ácidos carboxílicos
Debido a su estructura, los ácidos carboxílicos, además de sus reacciones características, también sufren transformaciones similares a las de los alcoholes y las cetonas. Al igual que los alcoholes, pueden disociar un protón para formar un reactivo nucleófilo. Al igual que las cetonas, están sujetos a ataques de otros nucleófilos sobre el átomo de carbono del grupo carbonilo. Además, son posibles su reducción, sustitución en la posición alfa, sustitución nucleófila del grupo acilo y desprotonación (disociación). La reducción de ácidos carboxílicos se lleva a cabo con LiAlH 4 , dando el producto como un alcohol primario. A veces es necesario aplicar calor en una solución de tetrahidrofurano para aumentar la eficiencia. Otro método es una reducción usando borano en solución de tetrahidrofurano, obteniendo también 1 o alcoholes.
