Por definición, la actividad química es la capacidad de un elemento de donar electrones en reacciones químicas. En la práctica, su actividad aumenta al disminuir la electronegatividad, una medida de la capacidad de un elemento para atraer electrones. Si un metal no atrae fuertemente los electrones, es más reactivo. Un elemento de referencia, el hidrógeno, se utiliza para clasificar la actividad química de los metales. Una medida de la actividad de un metal es su capacidad para desplazar el hidrógeno de los ácidos o el hidrógeno de una molécula de agua.

Serie de actividad química de metales.
Este término se utiliza para describir el resumen de elementos químicos que son de naturaleza metálica , en un orden específico del menos al más químicamente activo. Esto se utiliza para comparar la actividad de diferentes metales. Además de los metales, la serie de actividad química también incluye un no metal, el hidrógeno , que es el elemento de referencia. Cuanto más arriba en la serie de actividades se encuentra un metal, más reactivo es . También está relacionado con el hecho de que se oxida más fácilmente y, por lo tanto, es un reductor más fuerte y un elemento químicamente más activo. Por el contrario, cuanto más abajo se sitúa un metal en la serie de actividad, menos reactivo es. Esto significa que sufre una reacción de reducción más fácilmente y, por tanto, es un oxidante más fuerte, un elemento menos activo. Usando los valores mostrados en la Tabla 1, podemos ver que cuanto menor es el valor del potencial estándar de un elemento, más fuerte será el reductor y más reactivo químicamente el metal. Una medida de la capacidad de donar electrones en una variedad de actividades metálicas es su valor potencial estándar . Para el hidrógeno, o mejor dicho para el electrodo de hidrógeno, se supone que el potencial estándar es cero. El potencial estándar es la fuerza electromotriz de una celda formada por una media celda de hidrógeno estándar y la otra media celda en la que las concentraciones de sustratos y productos son de 1 mol/dm 3 .
| Electrodo | Potencial estándar [V] |
| Li/Li + | -3.04 |
| Ca/Ca2 + | -2,86 |
| Mg/Mg 3+ | -2,36 |
| Al/Al 3+ | -1,69 |
| Mn/Mn 2+ | -1.18 |
| Zn/Zn2 + | -0,76 |
| Cr/Cr 3+ | -0,74 |
| Fe/Fe 2+ | -0,44 |
| CD/CD 2+ | -0,40 |
| Co/Co 2+ | -0,28 |
| Ni/Ni 2+ | -0,26 |
| Sn/Sn2 + | -0,14 |
| Pb/Pb 2+ | -0,14 |
| Fe/Fe 3+ | 0,04 |
| H2 /2H + | 0.00 |
| Bi/Bi 3+ | +0.32 |
| Cu/Cu2 + | +0.34 |
| Ag/Ag + | +0.80 |
| Hg/Hg2 + | +0.85 |
| Au/Au 3+ | +1.52 |
Tabla 1 . Serie electroquímica de metales Los metales visibles en la parte superior de la serie son los más activos. Los que están por encima del hidrógeno tienden a oxidarse fácilmente y, por lo tanto, son agentes reductores más fuertes que el hidrógeno. Los elementos debajo del hidrógeno en la serie se reducen más fácilmente y son oxidantes más fuertes. Si un metal tiene un potencial más negativo que otro, esto significa que lo desplazará de su sal. Por ejemplo, el hierro desplazará al cobre en las sales de cobre, pero el cobre no desplazará al hierro de sus sales. En cambio, puede desplazar la plata de las sales de plata. El litio y el berilio de soluciones de sales de otros metales no los desplazan, sino que reaccionan directamente con el agua. Desplazan el hidrógeno y producen sus compuestos: los hidróxidos . Estos metales se denominan metales activos. Actividad de los metales y tabla periódica de los elementos Como muchas otras propiedades, la actividad química de un elemento se puede deducir de su posición en la tabla periódica . Los metales más activos son los de los grupos I y II, ya que desplazan fácilmente el hidrógeno del agua para formar hidróxidos. En el grupo, la actividad química de los metales aumenta al aumentar el número atómico . El período disminuye a medida que aumenta el número atómico. 
Metales preciosos y comunes.
El hidrógeno no sólo proporciona un punto de referencia de actividad, sino que también separa los metales preciosos y básicos en la serie . Los metales básicos son aquellos que están por encima del hidrógeno. Cada uno reacciona con los ácidos, desplazando el hidrógeno de ellos. Del potasio al calcio reaccionan con el agua ya a temperatura ambiente, y del magnesio al hierro reaccionan con ella a temperaturas elevadas. Todos los metales que están por debajo del hidrógeno en la serie de actividad no desplazan el hidrógeno de los ácidos . Sin embargo, pueden reaccionar con ácidos oxidantes para formar las correspondientes sales y óxidos , que se forman reduciendo el residuo ácido. Los elementos que se encuentran al final de la serie, desde la plata hasta el oro, son tan resistentes a las reacciones químicas que solo reaccionan con agua regia . Dicha solución es una mezcla de una solución concentrada de ácido clorhídrico y una solución concentrada de ácido nítrico (V) , mezcladas en una proporción de volumen de 3:1. Conociendo estos hechos podemos deducir que se pueden realizar varias reacciones para distinguir la actividad del elemento: con agua a temperatura ambiente, con agua caliente, con ácido no oxidante, con ácido oxidante y con agua regia.
Experimento para detectar metales que desplazan el hidrógeno de los ácidos
La forma más sencilla de confirmar la actividad del metal es realizar un experimento. Para ello se deben preparar diez tubos de ensayo en los que se colocarán sucesivamente: en 1-5: cinta de magnesio, alambre de zinc, alambre de hierro, alambre de níquel y alambre de cobre. Se debe repetir el mismo orden en los tubos 6-10. Agregue unos mililitros de ácido clorhídrico a los tubos 1-5 y unos mililitros de ácido sulfúrico diluido (VI) a los tubos 6-10. Aplique una férula ardiente a cada tubo. En los tubos de ensayo que contienen cintas de magnesio y alambres de hierro, zinc y níquel, inundados de ácidos, se emiten burbujas de gas. La liberación más intensa se puede observar en tubos que contienen magnesio. Las reacciones que se producen son las siguientes: 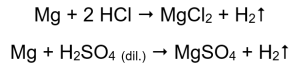 La cantidad de gas emitido disminuye en la serie: zinc, hierro, níquel. En consecuencia, se producen las siguientes reacciones:
La cantidad de gas emitido disminuye en la serie: zinc, hierro, níquel. En consecuencia, se producen las siguientes reacciones:  En los tubos que contenían alambres de cobre, no se ve gas ni cambios. Esto significa que no ocurren tales reacciones:
En los tubos que contenían alambres de cobre, no se ve gas ni cambios. Esto significa que no ocurren tales reacciones: 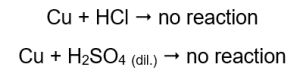 Cuando se aplica una férula ardiente, se escucha un sonido distintivo en los tubos por los que se emite el gas.
Cuando se aplica una férula ardiente, se escucha un sonido distintivo en los tubos por los que se emite el gas.
Resumen de observaciones y conclusiones:
El magnesio, el zinc, el hierro y el níquel reaccionan tanto con el ácido clorhídrico como con el ácido sulfúrico (VI). Cada uno desplaza el hidrógeno del ácido, lo que significa que están más arriba en la serie de actividad del metal que el ácido. Las reacciones producen productos en forma de sales y un gas, hidrógeno, que se libera. El sonido distintivo que acompañó la aplicación de una férula incandescente a un tubo de ensayo con gas que se escapa es causado por la reacción del hidrógeno con el oxígeno. De todos los metales analizados, el magnesio es el más reactivo, seguido del zinc, hierro, níquel y cobre. Podemos saberlo porque la intensidad de las burbujas de gas indica la actividad del metal. No se observaron cambios en los tubos que contenían cobre. Esto muestra que el cobre no puede desplazar el hidrógeno ni del ácido clorhídrico ni del ácido sulfúrico (VI) diluido.
