En términos de estructura química, los alcanos pertenecen al grupo de los hidrocarburos. Estos compuestos contienen solo dos tipos de átomos: carbono e hidrógeno. Están compuestos por el marco de carbono base unido con átomos de hidrógeno. Los alcanos solo tienen enlaces simples, por eso se les llama hidrocarburos saturados.

Series homólogas
Dispuestos por la creciente cantidad de átomos de hidrógeno en su estructura, los representantes de los alcanos forman una serie homóloga. Comienza con metano, que contiene un átomo de carbono, y termina con decano con nueve átomos de carbono. Los nombres de los alcanos provienen de la cantidad de átomos de carbono que existen en la estructura y se definen con números griegos o latinos así como con la característica terminación -ano, al igual que con heptano, nonano, etc. La fórmula general de los alcanos es la siguiente: , donde ‘n’ representa el número de carbono (C) presente en la cadena y ‘H’ representa los átomos de hidrógeno.
| El número de átomos de carbono presentes en la cadena. | fórmula alcano | Nombre de alcano |
| 1 | Canal 4 | Metano |
| 2 | C 2 H 6 | etano |
| 3 | C 3 H 8 | Propano |
| 4 | C 4 H 10 | Butano |
| 5 | C 5 H 12 | pentano |
| 6 | C 6 H 14 | Hexano |
| 7 | C 7 H 16 | heptano |
| 8 | C 8 H 18 | Octano |
| 9 | C 9 H 20 | nonano |
| 10 | C 10 H 22 | decano |
Tipos de hidrocarburos saturados
En cuanto a la estructura de la cadena, distinguimos los siguientes tipos de alcanos:
-
Alcanos lineales (parafina)
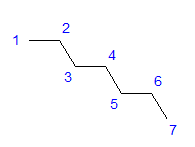 Fig. 1 Fórmula estructural del heptano Todos los átomos de carbono muestran la hibridación sp 3 . Debido a un ángulo tetragonal entre los enlaces, se requiere una disposición de átomos de carbono en forma de zigzag. Las moléculas pueden adoptar varios arreglos, ya que es posible la rotación libre alrededor de un enlace simple entre los átomos de carbono. Cuanto mayor sea el número de carbonos en la estructura, más variadas pueden ser las formas de la cadena.
Fig. 1 Fórmula estructural del heptano Todos los átomos de carbono muestran la hibridación sp 3 . Debido a un ángulo tetragonal entre los enlaces, se requiere una disposición de átomos de carbono en forma de zigzag. Las moléculas pueden adoptar varios arreglos, ya que es posible la rotación libre alrededor de un enlace simple entre los átomos de carbono. Cuanto mayor sea el número de carbonos en la estructura, más variadas pueden ser las formas de la cadena.
-
Isoalcanos: hidrocarburos saturados ramificados
La formación de hidrocarburos ramificados es el efecto de la unión entre un átomo de carbono y más de otros dos átomos de carbono. Se forma una rama en el punto de dicho enlace. Los hidrocarburos ramificados son isómeros de hidrocarburos lineales. 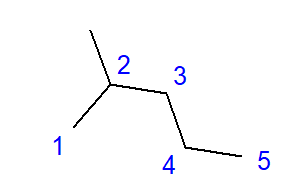 Fig. 2 Fórmula estructural del 2-metilpentano La fórmula del 2-metilpentano que se muestra en la Fig. 2 tiene un total de seis átomos de carbono y es un isómero de hexano. El nombre ‘2-metilpentano’ significa que la cadena de pentano tiene un grupo metilo enlazado en la posición del segundo átomo de carbono. El número de posibles isómeros estructurales crece junto con el creciente número de carbonos. Para dar un ejemplo, el hexano puede tener una estructura de 5 isómeros diferentes, el octano tiene 18 posibilidades y el hexano hasta 75.
Fig. 2 Fórmula estructural del 2-metilpentano La fórmula del 2-metilpentano que se muestra en la Fig. 2 tiene un total de seis átomos de carbono y es un isómero de hexano. El nombre ‘2-metilpentano’ significa que la cadena de pentano tiene un grupo metilo enlazado en la posición del segundo átomo de carbono. El número de posibles isómeros estructurales crece junto con el creciente número de carbonos. Para dar un ejemplo, el hexano puede tener una estructura de 5 isómeros diferentes, el octano tiene 18 posibilidades y el hexano hasta 75.
-
Hidrocarburos cíclicos: cicloalcanos, hidrocarburos alicíclicos
Es posible cerrar la estructura de la cadena mientras se forman anillos compuestos por elementos repetidos -CH 2 -. Los nombres se basan en el nombre del alcano con el prefijo ‘ciclo-‘, como ciclobutano o cicloheptano. Para hacerlo más fácil, se pueden presentar como polígonos regulares. 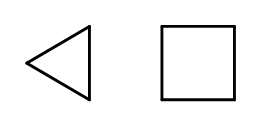 Fig. 3 Desde la izquierda: ciclopropano, ciclobutano También hay anillos sustitutos, cuyos nombres incluyen los sustituyentes. En este caso, el número de átomos de carbono está diseñado de tal manera que la ubicación de los sustituyentes es posiblemente baja.
Fig. 3 Desde la izquierda: ciclopropano, ciclobutano También hay anillos sustitutos, cuyos nombres incluyen los sustituyentes. En este caso, el número de átomos de carbono está diseñado de tal manera que la ubicación de los sustituyentes es posiblemente baja.
Representantes más importantes
El metano es un compuesto de fórmula molecular CH 4 , que inicia la serie homóloga de los alcanos. El carbono es tetravalente, por lo que tiene cuatro enlaces CH. A temperatura ambiente, es un gas inodoro e incoloro. Como el átomo de carbono muestra la hibridación sp 3 , está estructurado como tetraedro, y los orbitales producidos forman enlaces equivalentes junto con cuatro átomos de hidrógeno. El etano es el siguiente alcano de la serie, cuya fórmula molecular es C 2 H 6 . Al observar la fórmula semiestructural H 3 C-CH 3 , notaremos que cada átomo de carbono está unido a tres átomos de hidrógeno. Al igual que el metano y otros hidrocarburos inferiores, es un gas incoloro e inodoro. Los enlaces CH son enlaces frontales sigma sp-s, mientras que un enlace simple entre átomos de carbono es un enlace frontal sigma sp-sp.
La síntesis de alcanos.
- La hidrogenación de alquenos o alquinos.

- La hidrólisis de los compuestos de Grignard
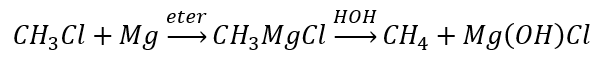
- La reducción de haluros de alquilo
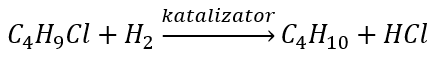
- Reacción de Wurtz
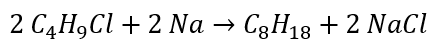
La reducción de aldehídos y cetonas.
- reducción de Clemmensen
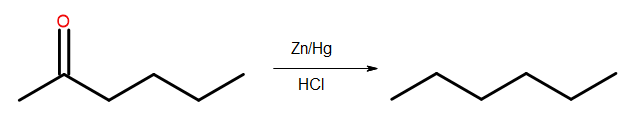 Fig. 4 Diagrama de reducción de Clemmensen
Fig. 4 Diagrama de reducción de Clemmensen
- Reacción de Wolff-Kishner
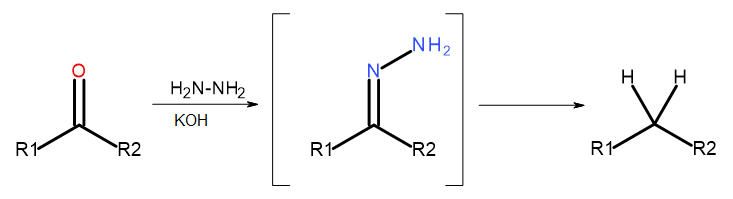 Fig. 5 Diagrama de Wolff-Kishner
Fig. 5 Diagrama de Wolff-Kishner
Las propiedades físico-químicas de los alcanos.
Los alcanos de cadena corta de C 1 a C 4 a temperatura ambiente son gases. Otros homólogos (a partir del pentano) son líquidos con un punto de ebullición creciente. Las ramificaciones presentes en la estructura dan como resultado un punto de ebullición más bajo de los isómeros. La dependencia de agregar otro grupo -CH 2 – en la estructura eleva el punto de ebullición alrededor de 20-30 o C más alto junto con el aumento de la longitud de la cadena de carbono. El estado de agregación de los alcanos a partir del octadecano es sólido con puntos de fusión a partir de 28 o C para el n-octadecano. Los hidrocarburos sólidos incluyen parafina, mientras que los hidrocarburos líquidos superiores incluyen aceite de parafina. Debido a su naturaleza hidrófoba, las moléculas de alcano no se mezclan con agua, no se humedecen con agua y no se disuelven en agua. Sin embargo, con su afinidad por las características no polares, se disuelven fácilmente en sí mismos y en disolventes orgánicos similares no polares, de polaridad media y baja. La solubilidad de los alcanos en dos solventes alcohólicos populares (metanol y etanol) es relativamente buena. En metanol, los alcanos se disuelven bien solo hasta una concentración específica. El exceso de esa concentración hace que las fases se separen. En etanol, los alcanos inferiores se disuelven muy fácilmente, mientras que es un poco más difícil disolver los alcanos superiores. Los hidrocarburos superiores son sustancias inflamables. Los hidrocarburos gaseosos, así como los pares de hidrocarburos líquidos, forman mezclas con potencial de explosión cuando se mezclan con el aire. La reactividad de los alcanos es relativamente baja debido a la falta de grupos funcionales potencialmente reactivos. Los enlaces entre los átomos de carbono (CC), así como entre los átomos de carbono y oxígeno (CH), son muy resistentes a la escisión. Las energías de estos enlaces son 88 kcal/mol y 104 kcal/mol, respectivamente. Pueden reaccionar abruptamente solo en ciertas condiciones.
Las reacciones de los alcanos.
- Combustión completa – con emisión de dióxido de carbono
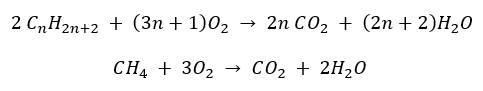
- Semicombustión : con oxígeno limitado y emisión de monóxido de carbono.
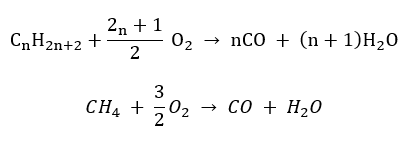
- Combustión incompleta : se forma negro de humo con una cantidad muy limitada de oxígeno.
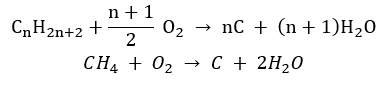
- La reacción de sustitución (halogenación radical, ejemplificada por la reacción del metano con cloro con la participación de la luz)
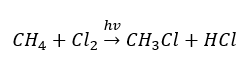
- La pirólisis es la descomposición de alcanos en moléculas más pequeñas a una temperatura muy alta. Dependiendo del proceso, puede ocurrir craqueo, hidrocraqueo o isomerización.
- Nitración con el uso de ácido nítrico (V) y la formación de una mezcla de productos: isómeros con el sustituyente –NO 2 en varios lugares.
- Sulfonación en dos etapas, donde los mersoles son productos intermedios y los mersolanos son el producto final.
