Los alquenos son hidrocarburos insaturados que, como los alcanos, forman una serie homóloga. Sin embargo, a diferencia de los alcanos, los alquenos tienen un enlace múltiple, un enlace doble, entre los átomos de carbono. Los restantes son enlaces simples, pero la presencia de incluso un enlace múltiple en una molécula hace que el hidrocarburo sea un compuesto insaturado.

La estructura de los alquenos.
El enlace CC entre átomos en hidrocarburos saturados hace que cada uno de ellos tenga una hibridación sp 3 . En los alquenos, que tienen enlaces C=C, se produce una hibridación sp 2 . Esta propiedad hace que la estructura de los compuestos con dobles enlaces sea una forma trigonal. Sus enlaces 3 sigma están en el mismo plano y miran hacia las esquinas del triángulo equilátero, cuyo centro es el átomo de carbono. Por el contrario, los enlaces pi resultan de la superposición de un orbital p no híbrido en una dirección perpendicular al triángulo, que se forma a partir de orbitales híbridos y los orbitales de simetría similar del átomo vecino. La construcción más simple del grupo, y el primer compuesto en la serie de homólogos de alquenos, es el eteno. El metano, un compuesto que es el primero de los alcanos, no pudo formar un enlace múltiple.
Un ejemplo de la estructura del alqueno.
Tomemos el compuesto más simple del grupo, eteno, y examinemos su estructura. Sabemos que los átomos de carbono en la molécula de eteno tienen una hibridación sp 2 , por lo que la molécula es plana. Los ángulos entre enlaces en este diseño son 120 o . Los cuatro enlaces entre los átomos de carbono e hidrógeno presentes en la estructura CH son enlaces sigma δ SP-s con una superposición frontal. También se forman enlaces homonucleares entre los átomos de carbono. Uno es CC δ sp-sp y el otro es CC π pp , que se forma a partir de orbitales p no híbridos.
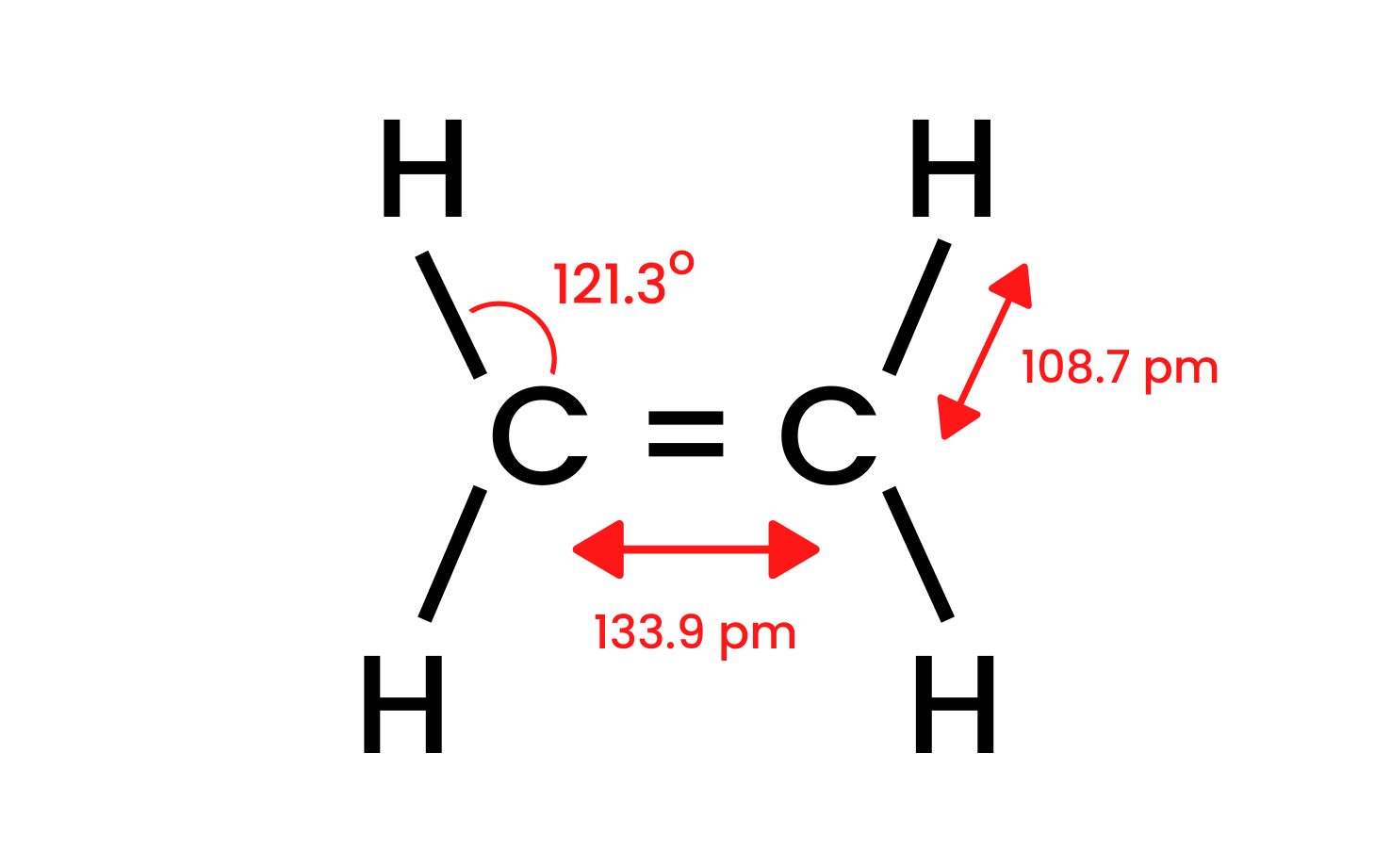
Figura 1. La estructura de ethene
Serie homóloga de alqueno
Una serie homóloga es un grupo de compuestos químicos que tienen una estructura química y propiedades muy similares. Tales sustancias también se pueden escribir con una fórmula molecular común. La fórmula general para los alquenos se puede escribir como C n H 2n . Estructuralmente, se ve así:
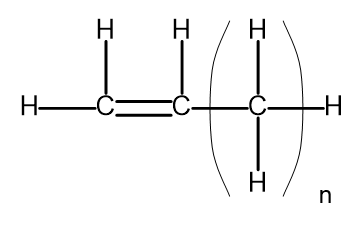
Figura 2. Fórmula estructural general de los alquenos
| Número de átomos de carbono en la cadena. | fórmula alcano | Nombre de alcano | Fórmula de alqueno | Nombre de alqueno |
| 2 | C 2 H 6 | etano | C 2 H 4 | eteno |
| 3 | C 3 H 8 | Propano | C 3 H 6 | propeno |
| 4 | C 4 H 10 | Butano | C 4 H 8 | buteno |
| 5 | C 5 H 12 | pentano | C 5 H 10 | Penteno |
| 6 | C 6 H 14 | Hexano | C 6 H 12 | hexeno |
| 7 | C 7 H 16 | heptano | C 7 H 14 | hepteno |
| 8 | C 8 H 18 | Octano | C 8 H 16 | octeno |
| 9 | C 9 H 20 | nonano | C 9 H 18 | ninguno |
| 10 | C 10 H 22 | decano | C 10 H 20 | Decena |
Los compuestos del buteno al deceno pueden tener ramificaciones en ubicaciones iguales de átomos de carbono, por lo que también pueden llamarse but-1-eno, hept-1-eno o dec-1-eno. Esto significa que el enlace insaturado está presente entre los átomos de carbono que inician la cadena. El fenómeno de las diversas posibilidades de colocación del enlace múltiple insaturado se denomina isomería posicional. Por ejemplo, un compuesto con la fórmula molecular C 7 H 14 tiene varios isómeros posicionales posibles. El doble enlace en su estructura se puede ubicar, por ejemplo, en los átomos de carbono número uno y tres, como se muestra en la Figura 3.
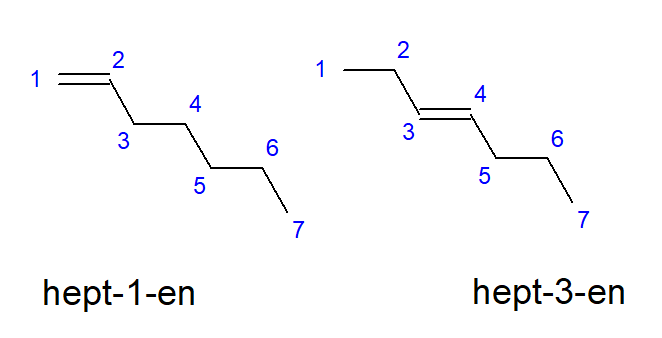
Figura 3. Fórmulas estructurales de hept-1-ene (1-heptene) y hept-3-ene (3-heptene)
Estructura de los alquenos – resumen
Cada alqueno tiene un doble enlace pi (π) en el que se crean estructuras planas. Los átomos de carbono tienen una hibridación sp 2 , caracterizada por una forma trigonal. En lugares saturados, los grupos -CH 2 – metileno pueden crear cadenas lineales y ramificadas espacialmente expandidas. La rotación ocurre solo alrededor de los enlaces simples y no ocurre en el caso del enlace C=C. Las propiedades físicas y químicas básicas del grupo de los alquenos Los alquenos tienen propiedades hidrofóbicas y, por lo tanto, tienen una naturaleza no polar. Entran en reacciones con el agua. Debido a su afinidad, se disuelven bien en disolventes no polares como los alcanos. El punto de fusión, el punto de ebullición y la densidad de los alquenos aumentan a medida que aumenta el número de átomos de carbono en la molécula. Su actividad es la mayor en alquenos de cadena corta.
Obtención de alquenos
Hay varias formas de obtener alquenos. Cada una de estas formas se basa en la eliminación de dos sustituyentes en un enlace simple, como se muestra en el diagrama:
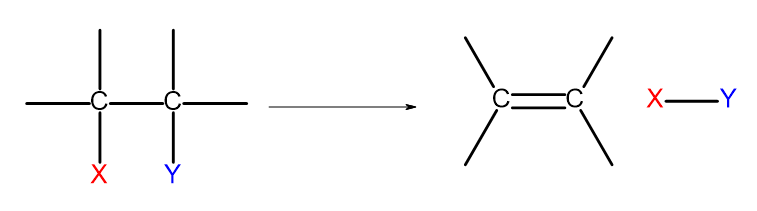
Figura 4. El diagrama del proceso de eliminación que da como resultado la formación de un alqueno
Obtención de eteno
1. Deshidrogenación de un alcano 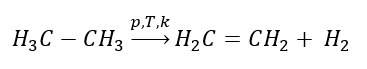 2. Deshidratación de un alcohol
2. Deshidratación de un alcohol 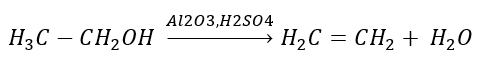 3. La reacción de un halógeno-alcano con una base fuerte
3. La reacción de un halógeno-alcano con una base fuerte 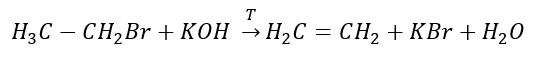 4. La reacción de un dihalógeno-alcano con polvo de zinc.
4. La reacción de un dihalógeno-alcano con polvo de zinc. 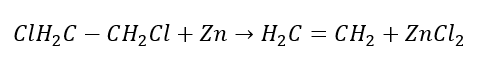 5. Hidrogenación de un alquino
5. Hidrogenación de un alquino 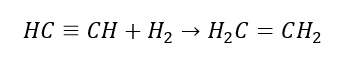
Reacciones químicas de alquenos.
Un fragmento específico de partícula, que al mismo tiempo define sus propiedades y afiliación, se denomina grupo funcional. Para los alquenos, este grupo es un doble enlace (C=C). El enlace pi (π) que contiene es muy susceptible de romperse. En comparación con los electrones de los enlaces sigma, los electrones que ocupan el orbital pi están más alejados de los átomos de carbono y, por lo tanto, menos asociados con ellos. Esto da como resultado su mayor movilidad y mayor disponibilidad para acercarse a los reactivos, lo que resulta en una alta reactividad química del enlace. Existen varios tipos de reacciones según las cuales se transforman los alquenos. Estos son: adición electrofílica, adición de radicales libres, oxidación y reducción, polimerización y sustitución alílica.
Adición electrófila
Por la naturaleza de los electrones del enlace pi, los agentes que los atacan tienen un carácter electropositivo. Tales moléculas son reactivos electrofílicos que tienen una alta afinidad por los electrones. En la mayoría de los casos, este factor es un protón de origen ácido, una brecha de electrones o una molécula que se polariza fácilmente como resultado de estar cerca de los electrones pi. La adición, es decir, la reacción de conexión, sigue el mecanismo iónico. Este es un mecanismo de dos pasos mediante el cual un reactivo electrofílico que se acerca inicialmente captura los electrones del enlace pi con la creación de un enlace simple y la formación de un carbocatión transitorio. Esta molécula altamente reactiva ataca rápidamente a otros reactivos que tienen la capacidad de mutualizar electrones. Ejemplos de tales reacciones son las adiciones de cloro o bromo a un alqueno. También se puede añadir hidrógeno (hidrogenización) por adición, pero no es electrofílico.
Reacciones de adición de radicales libres
Muchas reacciones de alquenos muestran incumplimiento de la regla de Markovnikov. Su mecanismo se centra en la reacción de los electrones del enlace pi a los radicales libres, durante la cual se produce un enlace de partículas que atacan al carbono. Como resultado de estos cambios, se obtiene un nuevo radical libre que tiene un electrón desapareado en el átomo de carbono vecino.
sustitución alílica
Además de la reacción que involucra el doble enlace, los alquenos también pueden reaccionar de una manera similar a la de los alcanos en los grupos alquilo vecinos. Un ejemplo de tal reacción es la sustitución de un átomo de hidrógeno con halógeno en el átomo próximo al átomo de carbono que forma el doble enlace. Esta reacción no afecta a la parte no saturada de la estructura.
























































































































