Una mezcla homogénea de al menos dos sustancias se considera una solución. Aunque pensamos en una solución principalmente como un líquido, las mezclas gaseosas y sólidas también son soluciones. Sin embargo, un grupo muy grande de reacciones químicas, tanto a escala de laboratorio como industrial, ocurre en un ambiente acuoso. Hay tres tipos de soluciones líquidas: el solvente siempre es líquido, pero el soluto puede ser gas, líquido o sólido. Entre los ejemplos se encuentran soluciones acuosas de cloruro de hidrógeno, etanol y sal de cocina.

Describiendo la composición de la solución.
La característica más importante de cualquier solución es la definición de su composición. La habilidad para determinar la composición de una solución y recalcularla dependiendo de las unidades de interés es una habilidad básica de todo químico. La cantidad de un ingrediente dado en una mezcla se puede definir de varias maneras, por ejemplo, por masa, volumen o molaridad. Por esta razón, también existen varios tipos de concentraciones, que definen la dependencia de la cantidad del componente con la cantidad de la solución o mezcla. La mayoría de las veces, cuando describimos la composición de las soluciones, usamos los términos: fracción de masa, fracción de volumen, fracción molar y concentración molar. Las fracciones indican qué parte de una mezcla dada representa el ingrediente de interés. Se pueden expresar en unidades de masa, volumen o moles del compuesto.
Concentración molar
Esta es la concentración elegida con mayor frecuencia, debido a la conveniencia de su uso al determinar el número de moles de la sustancia contenida en el volumen de la solución. La base teórica es la afirmación de que las soluciones de dos sustancias diferentes de la misma concentración y volumen, a la misma temperatura, contienen el mismo número de moles y, por lo tanto, el mismo número de moléculas del soluto. Sobre la base de esta relación, para soluciones con concentraciones molares iguales es posible mezclar volúmenes apropiados de soluciones para lograr la proporción correcta del número de moles determinado por los coeficientes estequiométricos. Esto significa que, si pensamos en reacciones del tipo A + B → C, donde un mol de sustancia A reacciona con un mol de sustancia B, se deben mezclar volúmenes iguales de ambas soluciones con la misma concentración molar para que la reacción se lleve a cabo por completo. En el caso de una reacción de tipo A + 2B → C, es decir, un mol de sustancia A reacciona con dos moles de sustancia B, se debe mezclar un volumen de solución A con dos volúmenes de solución B. En este caso, también hay otra solución, porque en lugar de usar soluciones equimolares en una relación de volumen 1:2, se puede usar un volumen de solución A y un volumen de solución B del doble de concentración. La concentración molar, denotada por C m , define el número de moles de sustancias contenidas en una unidad de volumen, más a menudo en 1 dm 3 , de una solución. La fórmula que permite el cálculo de la concentración molar es el cociente del número de moles de la sustancia (n s ) y el volumen total de la solución (V sol ) en dm 3 : 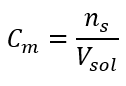 Utilizando la unidad básica de volumen según el sistema SI, es decir, el metro cúbico, los kilomoles deben utilizarse como unidad de cantidad de la sustancia. Sin embargo, este no es un problema computacional importante, ya que
Utilizando la unidad básica de volumen según el sistema SI, es decir, el metro cúbico, los kilomoles deben utilizarse como unidad de cantidad de la sustancia. Sin embargo, este no es un problema computacional importante, ya que 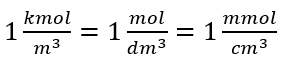 . La unidad de concentración molar C m se define como mol por decímetro cúbico, a menudo indicado como M. 1 mol/dm 3 = 1M
. La unidad de concentración molar C m se define como mol por decímetro cúbico, a menudo indicado como M. 1 mol/dm 3 = 1M 
El uso de la concentración molar.
a) Cálculo de la concentración molar en base al contenido del componente en la solución Ejemplo 1. La solución contiene 30 g de hidróxido de potasio en 3,0 dm 3 de solución. Calcular su concentración molar. Paso 1. Cálculo de la masa molar de KOH 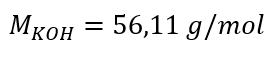 Paso 2. Cálculo del número de moles de KOH en la solución.
Paso 2. Cálculo del número de moles de KOH en la solución. 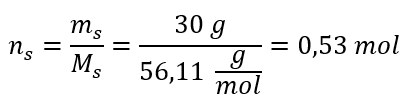 Paso 3. Cálculo de la concentración molar usando la fórmula
Paso 3. Cálculo de la concentración molar usando la fórmula 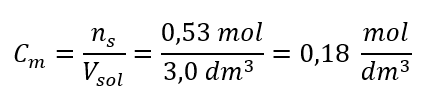 Respuesta: La concentración molar de una solución de hidróxido de potasio que contiene 30 g de la sustancia en 3,0 dm 3 de la solución es C m =
Respuesta: La concentración molar de una solución de hidróxido de potasio que contiene 30 g de la sustancia en 3,0 dm 3 de la solución es C m = 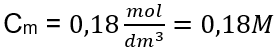 b) Preparación de una solución con una concentración dada Ejemplo 2. Calcular la masa de glucosa (C 6 H 12 O 6 ) necesaria para la preparación de 300 cm 3 de una solución con una concentración de 0,32 mol/dm 3 . Paso 1. Cálculo de la masa molar de la glucosa
b) Preparación de una solución con una concentración dada Ejemplo 2. Calcular la masa de glucosa (C 6 H 12 O 6 ) necesaria para la preparación de 300 cm 3 de una solución con una concentración de 0,32 mol/dm 3 . Paso 1. Cálculo de la masa molar de la glucosa 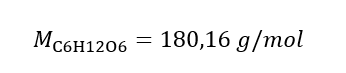 Paso 2. Cálculo de la masa de glucosa necesaria, utilizando la fórmula molar convertida, sabiendo que
Paso 2. Cálculo de la masa de glucosa necesaria, utilizando la fórmula molar convertida, sabiendo que 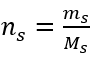 :
: 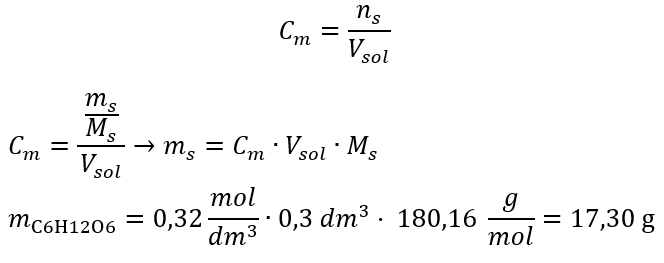 Después de estos cálculos, sabemos que para preparar tal solución, se deben pesar 17,30 g de glucosa y transferirlos cuantitativamente a un matraz volumétrico de 300 cm 3 . Respuesta: Para preparar 300 cm 3 de una solución de glucosa con una concentración molar de 0,32 mol/dm 3 , se deben pesar 17,30 g de la sustancia. c) Dilución y concentración de soluciones concentradas Usando la concentración molar, también podemos preparar una solución de una concentración dada (C m2 ) diluyendo la solución concentrada (C m1 ), donde:
Después de estos cálculos, sabemos que para preparar tal solución, se deben pesar 17,30 g de glucosa y transferirlos cuantitativamente a un matraz volumétrico de 300 cm 3 . Respuesta: Para preparar 300 cm 3 de una solución de glucosa con una concentración molar de 0,32 mol/dm 3 , se deben pesar 17,30 g de la sustancia. c) Dilución y concentración de soluciones concentradas Usando la concentración molar, también podemos preparar una solución de una concentración dada (C m2 ) diluyendo la solución concentrada (C m1 ), donde: 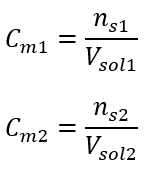 Durante la dilución, solo cambia el volumen de la solución, la cantidad de moles del soluto permanece sin cambios. Entonces uno puede suponer que:
Durante la dilución, solo cambia el volumen de la solución, la cantidad de moles del soluto permanece sin cambios. Entonces uno puede suponer que: ![]() Al transformar la fórmula de la concentración molar, obtenemos las siguientes relaciones:
Al transformar la fórmula de la concentración molar, obtenemos las siguientes relaciones: 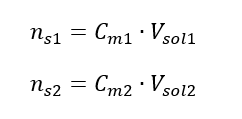 Sabiendo que obtenemos la ecuación:
Sabiendo que obtenemos la ecuación: 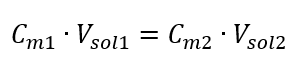 La fórmula para la dilución de soluciones, considerando la concentración molar, incluida la recién obtenida (C mx ), se puede señalar como:
La fórmula para la dilución de soluciones, considerando la concentración molar, incluida la recién obtenida (C mx ), se puede señalar como: 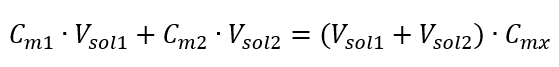 Ejemplo 3. ¿Qué volumen de ácido 0,150 mol/dm 3 se puede obtener diluyendo 250 cm 3 de una solución de 0,750 mol/dm 3 de este ácido con agua? Paso 1. Transformación de la fórmula suponiendo que la concentración de agua es C m2 = 0 mol/dm 3 .
Ejemplo 3. ¿Qué volumen de ácido 0,150 mol/dm 3 se puede obtener diluyendo 250 cm 3 de una solución de 0,750 mol/dm 3 de este ácido con agua? Paso 1. Transformación de la fórmula suponiendo que la concentración de agua es C m2 = 0 mol/dm 3 . 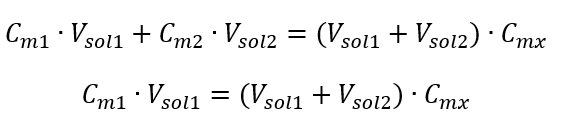 Paso 2. Cálculo del volumen total (V x )
Paso 2. Cálculo del volumen total (V x ) 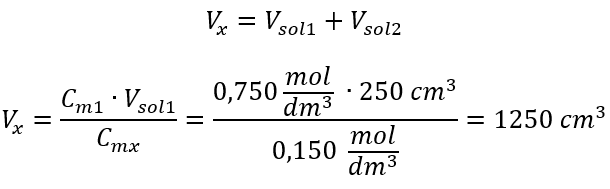 Alternativamente, se pueden utilizar las relaciones de permanencia del número de moles durante la dilución:
Alternativamente, se pueden utilizar las relaciones de permanencia del número de moles durante la dilución: 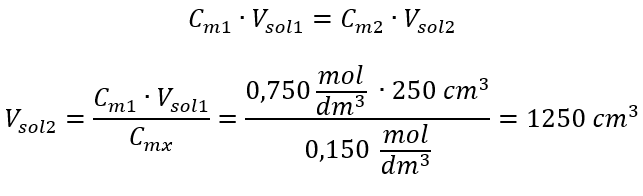 Respuesta: Para diluir el ácido a la concentración requerida se deben utilizar 1,25 dm 3 de agua. Ejemplo 4. Calcular la cantidad de agua que debe evaporarse de 300 cm 3 de una solución con una concentración de 0,125 mol/dm 3 para obtener una solución con una concentración de 1,50 mol/dm 3 . Paso 1. Transformación de la fórmula para el cambio en la concentración molar con el supuesto de que la concentración molar del agua es C m2 = 0 mol/dm 3 .
Respuesta: Para diluir el ácido a la concentración requerida se deben utilizar 1,25 dm 3 de agua. Ejemplo 4. Calcular la cantidad de agua que debe evaporarse de 300 cm 3 de una solución con una concentración de 0,125 mol/dm 3 para obtener una solución con una concentración de 1,50 mol/dm 3 . Paso 1. Transformación de la fórmula para el cambio en la concentración molar con el supuesto de que la concentración molar del agua es C m2 = 0 mol/dm 3 . 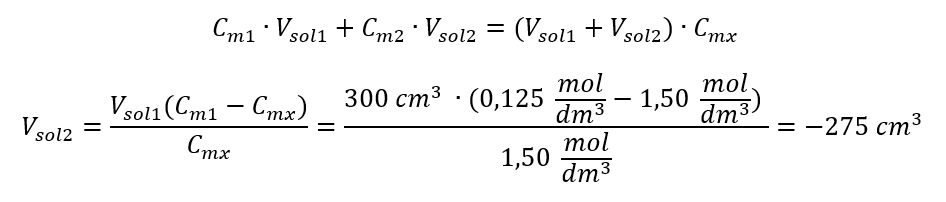 Respuesta: Para concentrar la solución, se debe evaporar 275. La conversión de concentración molar frente a concentración porcentual En el trabajo diario de laboratorio, es necesario convertir diferentes concentraciones de soluciones. Muy a menudo, se utilizan la concentración molar y la concentración porcentual. Es posible cambiar entre ellos usando la densidad de la solución. Este parámetro debe introducirse en las fórmulas de las concentraciones de interés:
Respuesta: Para concentrar la solución, se debe evaporar 275. La conversión de concentración molar frente a concentración porcentual En el trabajo diario de laboratorio, es necesario convertir diferentes concentraciones de soluciones. Muy a menudo, se utilizan la concentración molar y la concentración porcentual. Es posible cambiar entre ellos usando la densidad de la solución. Este parámetro debe introducirse en las fórmulas de las concentraciones de interés: 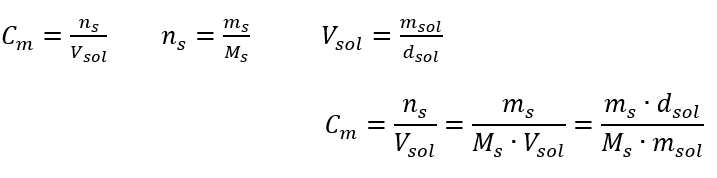 En la transformación, podemos ver la relación entre la masa de la sustancia y la masa de la solución, que es la base de la concentración porcentual, expresada por la fórmula:
En la transformación, podemos ver la relación entre la masa de la sustancia y la masa de la solución, que es la base de la concentración porcentual, expresada por la fórmula: 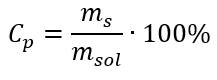 Sustituyendo la fórmula de la concentración porcentual en la fórmula de la concentración molar transformada previamente, obtenemos una relación que nos permite cambiar libremente entre los dos valores:
Sustituyendo la fórmula de la concentración porcentual en la fórmula de la concentración molar transformada previamente, obtenemos una relación que nos permite cambiar libremente entre los dos valores: 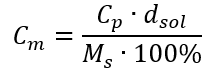 La única limitación de la fórmula es el uso de unidades apropiadas, por lo que vale la pena considerarlas en todos los cálculos. Ejemplo 5. Calcular la concentración molar de ácido sulfúrico (VI) sabiendo que su concentración porcentual es C p = 98,0%y su densidad es d = 1,84 kg/dm 3 . Esto se puede calcular usando dos métodos: Método 1. En unos pocos pasos, sin usar una fórmula Paso 1. Cálculo de la masa de 1.00 dm 3 del ácido
La única limitación de la fórmula es el uso de unidades apropiadas, por lo que vale la pena considerarlas en todos los cálculos. Ejemplo 5. Calcular la concentración molar de ácido sulfúrico (VI) sabiendo que su concentración porcentual es C p = 98,0%y su densidad es d = 1,84 kg/dm 3 . Esto se puede calcular usando dos métodos: Método 1. En unos pocos pasos, sin usar una fórmula Paso 1. Cálculo de la masa de 1.00 dm 3 del ácido 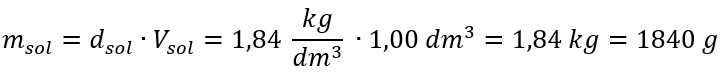 Paso 2. Cálculo de la masa del ácido teniendo en cuenta la concentración porcentual.
Paso 2. Cálculo de la masa del ácido teniendo en cuenta la concentración porcentual. 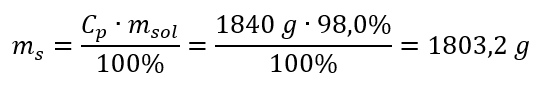 Paso 3. Cálculo del número de moles.
Paso 3. Cálculo del número de moles. 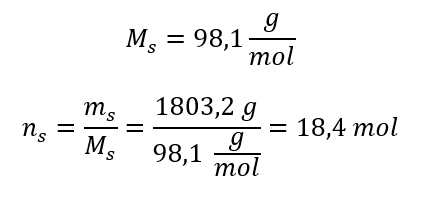 Paso 4. Cálculo de la concentración molar sabiendo que es el número de moles de la sustancia en 1 dm 3 de la solución
Paso 4. Cálculo de la concentración molar sabiendo que es el número de moles de la sustancia en 1 dm 3 de la solución 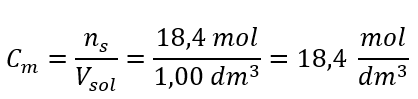 Método 2. Uso de la relación entre concentración porcentual y concentración molar
Método 2. Uso de la relación entre concentración porcentual y concentración molar 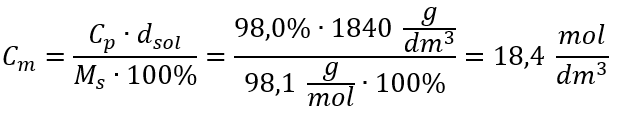 Respuesta: La concentración molar de este ácido es 18,4 mol/dm 3 .
Respuesta: La concentración molar de este ácido es 18,4 mol/dm 3 .
