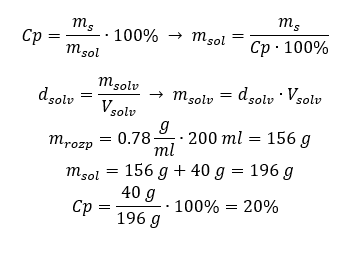En química, a menudo usamos términos como "solución concentrada", "solución diluida" o "solución saturada", pero solo nos dan un resumen básico de si la solución contiene una cantidad grande o pequeña de una sustancia en particular. Sin embargo, existen algunos métodos que nos ayudan a determinar con precisión la composición cuantitativa de una solución dada. Uno de ellos se analiza en el siguiente artículo.

Definición de concentración porcentual
El término "concentración" se refiere a una medida de la cantidad de una sustancia dada contenida en una solución particular . La concentración se puede expresar en unidades según las medidas que utilicemos, por ejemplo en moles, gramos o en porcentaje. La concentración porcentual indica cuántas partes en masa del soluto están incluidas en 100 partes en masa de la solución. En otras palabras, es la cantidad de gramos del soluto en 100 g de la solución. Por ejemplo, si compramos leche etiquetada con 3,2%, significa que 100 g de leche contienen 3,2 g de grasa. El porcentaje de concentración se abrevia como Cp.
Fórmula general de concentración porcentual
Para derivar la fórmula de concentración porcentual, se debe recordar que la masa de una solución (m sol ) contiene no solo la masa del solvente (m solv ) sino también la masa del soluto (m s ) : m sol = m solv + m s Por ejemplo, si tomamos una solución al 4%con una masa de 100 g, sabemos que Cp = 4%, por lo que la masa de la sustancia es 4 g. La definición de concentración porcentual indica que si la masa de la solución es 100 g, entonces la masa del solvente es 96 g. El porcentaje de concentración se puede calcular con la siguiente fórmula: Cp = (m s /m sol ) · 100%Como podemos ver en la fórmula, si conocemos la masa de la solución y la masa de la sustancia, podemos calcular fácilmente la concentración porcentual. Por ejemplo, si sabemos que la solución pesa 450 g y el soluto pesa 15 g, entonces al insertar estos números en la fórmula, obtenemos lo siguiente: Cp = (15/450) · 100%= 3.3%
Cálculo de la masa de los ingredientes individuales en una solución
Cada fórmula, incluida la de la concentración porcentual, se puede reorganizar. Si conocemos la concentración en masa y porcentaje de la solución, podemos calcular la masa del soluto. De manera similar, si conocemos la concentración porcentual y la masa de la sustancia, podemos calcular la masa de la solución. Además de reorganizar la fórmula, también podemos utilizar proporciones adecuadas. Ejemplo 1. ¿Cuántos gramos de azúcar necesitamos para preparar 300 g de una solución al 10%? Sabemos por las instrucciones que la masa de la solución es de 300 g y que su concentración porcentual es del 10%. La masa del soluto se puede determinar con dos métodos. Método 1. Reorganizar la fórmula 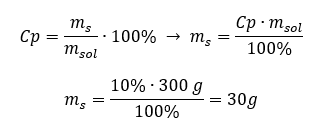 Método 2. Usando las proporciones , sabiendo que la solución al 10%contiene 10 g de azúcar en 100 g de la solución:
Método 2. Usando las proporciones , sabiendo que la solución al 10%contiene 10 g de azúcar en 100 g de la solución: 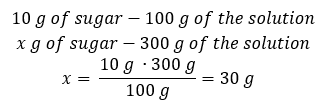 Ambos métodos nos llevarán a la conclusión de que la preparación de 300 g de una solución al 10 %requerirá 30 g de azúcar.
Ambos métodos nos llevarán a la conclusión de que la preparación de 300 g de una solución al 10 %requerirá 30 g de azúcar.  Ejemplo 2. ¿En cuántos gramos de agua tenemos que disolver 10 g de una sustancia para obtener una solución al 50%? Sabemos por las instrucciones que la masa de la sustancia es de 10 g y que la concentración porcentual de la solución es del 50%. Esto implica que 100 g de la solución contienen 50 g de la sustancia. La masa de la solución se puede determinar con dos métodos. Tenga en cuenta que la masa de la solución no es igual a la masa del disolvente. Para calcular la masa del solvente, tenemos que restar la masa de la sustancia de la masa de la solución. Método 1. Reorganizar la fórmula
Ejemplo 2. ¿En cuántos gramos de agua tenemos que disolver 10 g de una sustancia para obtener una solución al 50%? Sabemos por las instrucciones que la masa de la sustancia es de 10 g y que la concentración porcentual de la solución es del 50%. Esto implica que 100 g de la solución contienen 50 g de la sustancia. La masa de la solución se puede determinar con dos métodos. Tenga en cuenta que la masa de la solución no es igual a la masa del disolvente. Para calcular la masa del solvente, tenemos que restar la masa de la sustancia de la masa de la solución. Método 1. Reorganizar la fórmula 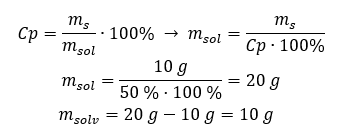 Método 2. Usando las proporciones , sabiendo que 100 g de la solución contienen 50 g de la sustancia.
Método 2. Usando las proporciones , sabiendo que 100 g de la solución contienen 50 g de la sustancia. 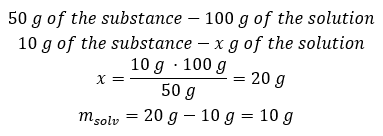 Independientemente del método que utilicemos, la respuesta será que para obtener una solución al 50 %debemos disolver 10 g de la sustancia en 10 g de agua.
Independientemente del método que utilicemos, la respuesta será que para obtener una solución al 50 %debemos disolver 10 g de la sustancia en 10 g de agua.
Preparando soluciones
Un elemento clave del trabajo en un laboratorio es el conocimiento de cómo preparar soluciones con concentraciones particulares. Para ello, tenemos que conocer la masa de sus ingredientes. Una masa previamente calculada de una sustancia debe disolverse en un volumen medido con precisión de un solvente. El volumen requerido se puede calcular si conocemos la masa y la densidad del líquido. La densidad de la solución es un valor físico específico de cada líquido, que define la masa de la solución por unidad de volumen. Ese valor está estrechamente relacionado con la temperatura. Si sabemos que la densidad de la solución es de 2,03 g/ml, también sabemos que 1 ml de la solución pesa 2,03 g. Solemos utilizar las siguientes unidades de densidad: g/ml = g/cm 3 , g/l = g/dm 3 , pero también existen otras, como kg/m 3 . La densidad de la solución se calcula con la siguiente fórmula: d sol =m sol /v sol , donde m sol es la masa de la solución y V sol es su densidad. Si conocemos el volumen y la densidad de la solución, podemos calcular su masa. Ejemplo 3. ¿Cuál es la masa de 20 ml de una solución con una densidad de 1,201 g/ml? Método 1. Reorganizar la fórmula 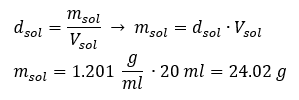 Método 2. Usando las proporciones , sabiendo que 1.201 g de la solución tiene un volumen de 1 ml
Método 2. Usando las proporciones , sabiendo que 1.201 g de la solución tiene un volumen de 1 ml 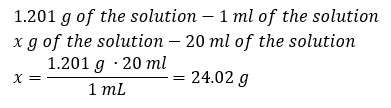 Ambos métodos han demostrado que la solución con una densidad de 1,201 g/ml y un volumen de 20 ml tiene una masa de 24,02 g. Si conocemos la densidad, podemos realizar aún más cálculos en el contexto del porcentaje de concentración. Ejemplo 4. ¿Cuántos gramos de sal hay en 10 ml de una solución al 15 %si su densidad es de 1,035 g/ml? Método 1. Reorganizar las fórmulas
Ambos métodos han demostrado que la solución con una densidad de 1,201 g/ml y un volumen de 20 ml tiene una masa de 24,02 g. Si conocemos la densidad, podemos realizar aún más cálculos en el contexto del porcentaje de concentración. Ejemplo 4. ¿Cuántos gramos de sal hay en 10 ml de una solución al 15 %si su densidad es de 1,035 g/ml? Método 1. Reorganizar las fórmulas 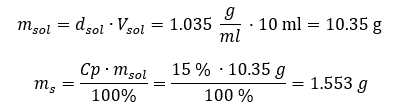 Método 2. Usando las proporciones
Método 2. Usando las proporciones 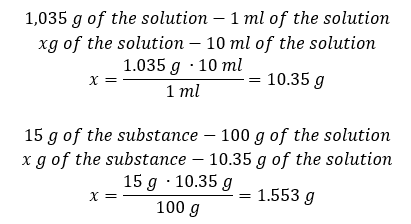 Ambos métodos han demostrado que para preparar 10 ml de una solución con Cp = 15%y una densidad de 1,035 g/ml, tenemos que pesar 1,553 g de sal. Ejemplo 5. ¿Cuál es el porcentaje de concentración de una solución que se obtiene al disolver 40 g de una sustancia en 200 ml de etanol con una densidad de 0,78 g/ml? Para hacer el cálculo, podemos utilizar la fórmula de concentración porcentual. La masa de la solución se puede calcular sumando las masas del soluto y del solvente. Se desconoce la masa del solvente, pero sabemos su densidad y volumen, por lo que los datos que faltan se pueden calcular reorganizando la fórmula de la densidad.
Ambos métodos han demostrado que para preparar 10 ml de una solución con Cp = 15%y una densidad de 1,035 g/ml, tenemos que pesar 1,553 g de sal. Ejemplo 5. ¿Cuál es el porcentaje de concentración de una solución que se obtiene al disolver 40 g de una sustancia en 200 ml de etanol con una densidad de 0,78 g/ml? Para hacer el cálculo, podemos utilizar la fórmula de concentración porcentual. La masa de la solución se puede calcular sumando las masas del soluto y del solvente. Se desconoce la masa del solvente, pero sabemos su densidad y volumen, por lo que los datos que faltan se pueden calcular reorganizando la fórmula de la densidad.