La disociación, en el contexto químico, significa la descomposición de una sustancia en otras moléculas. La palabra proviene del término latino “ dissociatio ”, que significa “separación”. En la nomenclatura científica, la disociación tiene varias definiciones, como también tiene su significado específico en psicología. Pero centrémonos en lo que significa la disociación en química. Según el curso del proceso y la sustancia utilizada, podemos distinguir cuatro tipos diferentes de disociación. El más popular es la disociación electrolítica, aunque la disociación térmica es igualmente importante.

disociación térmica
El proceso consiste en la descomposición de moléculas en moléculas más pequeñas o en átomos, bajo la influencia de la temperatura. La relación más importante es el hecho de que la temperatura utilizada para la disociación puede ser menor si el compuesto incluye enlaces químicos más débiles. Los que tienen una energía más alta necesaria para la descomposición requieren una temperatura más alta. Un ejemplo común de termólisis (disociación térmica) es la caramelización de la sacarosa, que ocurre a 160 o C.
disociación electrolítica
Descubierta en 1887 por el químico sueco Svante Arrhenius, es algo más compleja que la disociación térmica. La disociación electrolítica consiste en la descomposición de una sustancia, que ocurre cuando un solvente (generalmente agua) afecta a iones que se mueven libremente. Arrhenius ha demostrado en su investigación que los iones producidos por tal disociación hacen que la solución conduzca electricidad. Esta fue la base para desarrollar la clasificación de las sustancias químicas en electrolitos (soluciones capaces de conducir la corriente eléctrica) y no electrolitos (soluciones que no pueden conducir la corriente eléctrica).
electrolitos
El término “electrolitos” tiene dos significados: desde el punto de vista técnico, es cualquier sustancia que puede transferir iónicamente una carga entre electrodos. Como resultado, puede conducir corriente eléctrica iónicamente. El otro significado más químico de ese término se refiere a sustancias que experimentan disociación electrolítica como consecuencia de la fusión o disolución. Estas soluciones (la mayoría de las veces acuosas) también conducen la electricidad. Los ejemplos de tales electrolitos incluyen compuestos iónicos, como el cloruro de sodio (sal de mesa), pero también compuestos no iónicos, por ejemplo, ácido clorhídrico o hidróxido de potasio . Dadas sus propiedades específicas, los electrolitos pueden denominarse conductores eléctricos. Estos pueden dividirse en conductores de clase 1 (metales, sus aleaciones y carbono) y conductores de clase 2 (soluciones de bases, ácidos y sales ).
El mecanismo de la disociación electrolítica.
En un solvente cuya constante dieléctrica es alta (por ejemplo, 81 para el agua), las fuerzas de atracción mutua entre iones en una red cristalina se reducen considerablemente. Esto es cuando los iones se rompen, lo que hace que la sustancia se disuelva y secrete iones que se mueven libremente en la solución. Dichos procesos también ocurren debido a la interacción entre los iones y las moléculas de agua, que es consecuencia de una estructura polar de H 2 O. Según Nekrasov, el mecanismo de acción del agua durante la descomposición de un electrolito con una estructura iónica se inicia por el ion positivo de la sustancia, que atrae el polo opuesto de la molécula de agua, al mismo tiempo que aleja al ion positivo. El polo opuesto actúa de la misma manera, y ambos iones quedan rodeados por las moléculas de agua que han atraído. Tal atracción ocurre en ambas direcciones entre las moléculas dipolares y los iones, lo que hace que la fuerza de atracción de los iones en el electrolito sea mucho menor. Por lo tanto, el mecanismo se puede dividir en cuatro etapas principales: la transición de la estructura polar a la iónica, la formación de la estructura iónica y la hidratación de los iones. Los enlaces entre los iones y el disolvente, producidos por disociación, se denominan solvatos. Si el agua es el solvente, entonces se llaman hidratos.
La capa de hidratación
Es una capa compuesta por moléculas de agua que existen en la proximidad más cercana al ion, orientadas con sus polos opuestos. Los polos libres y cargados atraen más capas de agua, hasta que la fuerza de atracción del ion se vuelve más débil que la energía de movimiento molecular en la solución. La capa facilita la descomposición de las moléculas de electrolitos en cationes y aniones, y constituye una barrera que impide que los iones se vuelvan a unir para formar moléculas. 
Disociación de ácidos y bases: la ley de acción de masas
Los ácidos fuertes son los que muestran una disociación de gran alcance en una solución acuosa, y los ácidos débiles son los que se disocian solo en pequeña medida. Si comparamos la fuerza de diferentes ácidos, también debemos tener en cuenta algunos factores, como la tendencia de las moléculas de ácido a ceder sus protones o la concentración de la sustancia en cuestión. Sin embargo, existe un valor químico que no depende de la concentración pero que caracteriza de manera excelente las propiedades individuales de las moléculas: la constante de disociación. La derivación de la ecuación para ese valor debe comenzar escribiendo la ecuación para la disociación ácida . Para un ejemplo con un solo protón (HX), se verá así: ![]() Si la solución está diluida y el ácido es débil, podemos aplicar la ley de acción de masas, que se expresa de la siguiente manera:
Si la solución está diluida y el ácido es débil, podemos aplicar la ley de acción de masas, que se expresa de la siguiente manera: 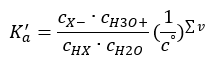 Hay dos formas de acortar la relación presentada. El primer paso es suponer que la concentración de agua es constante. También podemos omitir el símbolo c o , ya que expresa una concentración estándar igual a 1 mol/dm 3 . Sin embargo, es importante colocarlo en la fórmula inicial y tenerlo en cuenta a la hora de determinar la unidad. Esto se debe a que las constantes químicas son valores adimensionales. Por su parte, todas las concentraciones utilizadas en la fórmula están expresadas en mol/dm 3 . Entonces finalmente obtenemos la fórmula para la constante de disociación:
Hay dos formas de acortar la relación presentada. El primer paso es suponer que la concentración de agua es constante. También podemos omitir el símbolo c o , ya que expresa una concentración estándar igual a 1 mol/dm 3 . Sin embargo, es importante colocarlo en la fórmula inicial y tenerlo en cuenta a la hora de determinar la unidad. Esto se debe a que las constantes químicas son valores adimensionales. Por su parte, todas las concentraciones utilizadas en la fórmula están expresadas en mol/dm 3 . Entonces finalmente obtenemos la fórmula para la constante de disociación: 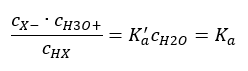 La relación que expresa la constante de disociación ácida (K a ) consiste en valores determinados experimentalmente, que caen dentro del rango de 10 -10 a 10 8 . Una operación popular es usar una fórmula logarítmica, expresada como un logaritmo negativo de la constante de disociación, designada como pK a : pK a = -logK a Es importante que mientras los valores bajos de Ka representan ácidos débiles y los valores altos representan ácidos fuertes , el pKa cambia de manera opuesta. Los valores de pKa bajos, generalmente negativos , corresponden a ácidos fuertes. Los valores altos de pKa positivos representan ácidos débiles. Cuando introducimos otro concepto, el grado de disociación (α), que es la relación entre el número de moles de las moléculas de un compuesto dado, que sufren disociación (descomposición en iones), al número total de moles de las moléculas de ese compuesto, presente en la solución, podemos desarrollar más la ecuación. Si ignoramos la concentración muy baja de iones de hidrógeno formados por la disociación del agua y usamos las concentraciones de equilibrio de iones y moléculas, podemos suponer que:
La relación que expresa la constante de disociación ácida (K a ) consiste en valores determinados experimentalmente, que caen dentro del rango de 10 -10 a 10 8 . Una operación popular es usar una fórmula logarítmica, expresada como un logaritmo negativo de la constante de disociación, designada como pK a : pK a = -logK a Es importante que mientras los valores bajos de Ka representan ácidos débiles y los valores altos representan ácidos fuertes , el pKa cambia de manera opuesta. Los valores de pKa bajos, generalmente negativos , corresponden a ácidos fuertes. Los valores altos de pKa positivos representan ácidos débiles. Cuando introducimos otro concepto, el grado de disociación (α), que es la relación entre el número de moles de las moléculas de un compuesto dado, que sufren disociación (descomposición en iones), al número total de moles de las moléculas de ese compuesto, presente en la solución, podemos desarrollar más la ecuación. Si ignoramos la concentración muy baja de iones de hidrógeno formados por la disociación del agua y usamos las concentraciones de equilibrio de iones y moléculas, podemos suponer que: 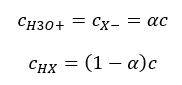 Entonces la constante de disociación se puede observar de la siguiente manera:
Entonces la constante de disociación se puede observar de la siguiente manera:  De esta forma, es la dependencia del grado de disociación de un electrolito de su concentración, es decir, la ley de dilución de Ostwald. Si analizamos electrolitos muy débiles, el grado de disociación (α) se puede asumir como <<1, y la fórmula se puede simplificar a la siguiente:
De esta forma, es la dependencia del grado de disociación de un electrolito de su concentración, es decir, la ley de dilución de Ostwald. Si analizamos electrolitos muy débiles, el grado de disociación (α) se puede asumir como <<1, y la fórmula se puede simplificar a la siguiente:  Los ácidos que contienen más de un protón se disocian en varias etapas, y debemos tener en cuenta todas sus etapas. Para dar un ejemplo, para el ácido ortofosfórico hay tres etapas:
Los ácidos que contienen más de un protón se disocian en varias etapas, y debemos tener en cuenta todas sus etapas. Para dar un ejemplo, para el ácido ortofosfórico hay tres etapas:
- H 3 PO 4 + H 2 O = H 2 PO 4 – + H 3 O +
- H 2 PO 4 – + H 2 O = HPO 4 2- + H 3 O +
- HPO 4 2- + H 2 O = PO 4 3- + H 3 O +
Cada etapa tiene su propia constante de equilibrio, que se puede observar de manera análoga a la primera:  Se tabulan las constantes de disociación, tanto para los hidrácidos como para los oxiácidos.
Se tabulan las constantes de disociación, tanto para los hidrácidos como para los oxiácidos.
| Ácido | Ka | pK un |
| AF | 6,3·10 -4 | 3.2 |
| HCl | 1·10 7 | -7 |
| HNO3 | 27.54 | -1.44 |
| H 3 PO 4 | 6.9·10 -3 | 2.16 |
Tabla 1. Valores de ejemplo de constantes de disociación para ácidos. Es similar para la estabilización del equilibrio de bases durante la disociación. Teniendo en cuenta la regla de ejemplo B, la ecuación se puede notar de la siguiente manera: ![]() Entonces, si deseamos derivar una constante de disociación para una base, utilizando la ley de acción de masas y asumiendo que la concentración de agua en la solución diluida es virtualmente constante, obtenemos la siguiente fórmula:
Entonces, si deseamos derivar una constante de disociación para una base, utilizando la ley de acción de masas y asumiendo que la concentración de agua en la solución diluida es virtualmente constante, obtenemos la siguiente fórmula:  Cuanto más fuerte es la base, mayor es la constante de disociación y menor el valor de pKb , mientras que cuanto menor es la constante de disociación y mayor el valor de pKb , más débil es la base.
Cuanto más fuerte es la base, mayor es la constante de disociación y menor el valor de pKb , mientras que cuanto menor es la constante de disociación y mayor el valor de pKb , más débil es la base.
| Base | kb | pKb |
| hidracina | 3·10 -6 | 5.5 |
| Amoníaco | 1.78·10 -5 | 4.75 |
| Metilamina | 5.0·10 -4 | 3.3 |
Tabla 2. Valores de ejemplo de constantes de disociación para bases. 
¿Qué determina la fuerza de los ácidos?
Si conocemos las expresiones de las constantes de disociación para ácidos particulares, podemos hacer algunas suposiciones verdaderas:
- La fuerza de un hidrácido aumenta junto con el aumento del número atómico del elemento vinculado con el átomo de hidrógeno.
- La fuerza de un hidrácido disminuye junto con el aumento de la electronegatividad del elemento unido al átomo de hidrógeno. Esto puede ser engañoso, ya que, en teoría, el aumento de la electronegatividad debería favorecer la extracción de protones.
- El tamaño del anión formado durante la disociación afecta la constante de disociación en mayor medida que la electronegatividad.
Autodisociación del agua
Un ejemplo interesante de disociación es la descomposición de las moléculas de agua. Dado que son capaces tanto de extraer protones como de desprenderse de ellos, el agua pura se autodisocia en pequeña medida, según la siguiente ecuación: H 2 O + H 2 O ↔ H 3 O + + OH – Como los ácidos y bases, también es posible aplicar la ley de acción de masas, que incluye concentraciones de equilibrio de agua no disociada así como sus aniones y cationes: 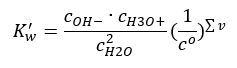 Resulta que las concentraciones de cationes H 3 O + y aniones OH – son tan pequeñas en comparación con el agua no disociada que incluso su alteración prácticamente no cambia la concentración de agua no disociada. Esto hace posible suponer que ese valor es constante y convertir la ecuación a la siguiente forma: K w = c OH – · c H3O + Es un aspecto particularmente importante en el contexto de los cálculos químicos, y tal constante se denomina como el producto iónico del agua. También se usa a menudo como un logaritmo negativo, designado como pKw . Esto es igual a –logKw . Según la ecuación, si el equilibrio iónico del agua se altera como resultado del suministro de iones H 3 O + , entonces para mantener la constancia del producto iónico debemos reducir la concentración de iones OH – . Del mismo modo, un exceso de iones OH – reduce la concentración de cationes. El producto de estas concentraciones debe ser constante. Los experimentos han demostrado que Kw a una temperatura de 298K es 10-14 . Por lo tanto, también podemos observar la ecuación válida para agua pura de la siguiente manera:
Resulta que las concentraciones de cationes H 3 O + y aniones OH – son tan pequeñas en comparación con el agua no disociada que incluso su alteración prácticamente no cambia la concentración de agua no disociada. Esto hace posible suponer que ese valor es constante y convertir la ecuación a la siguiente forma: K w = c OH – · c H3O + Es un aspecto particularmente importante en el contexto de los cálculos químicos, y tal constante se denomina como el producto iónico del agua. También se usa a menudo como un logaritmo negativo, designado como pKw . Esto es igual a –logKw . Según la ecuación, si el equilibrio iónico del agua se altera como resultado del suministro de iones H 3 O + , entonces para mantener la constancia del producto iónico debemos reducir la concentración de iones OH – . Del mismo modo, un exceso de iones OH – reduce la concentración de cationes. El producto de estas concentraciones debe ser constante. Los experimentos han demostrado que Kw a una temperatura de 298K es 10-14 . Por lo tanto, también podemos observar la ecuación válida para agua pura de la siguiente manera:  La disociación también está relacionada con el valor de pH de la solución. Las soluciones con concentraciones iguales de cationes H 3 O + y aniones OH – muestran un pH neutro. En soluciones ácidas la concentración de cationes es superior a 10 -7 mol/l, mientras que en soluciones alcalinas es inferior a 10 -7 mol/l.
La disociación también está relacionada con el valor de pH de la solución. Las soluciones con concentraciones iguales de cationes H 3 O + y aniones OH – muestran un pH neutro. En soluciones ácidas la concentración de cationes es superior a 10 -7 mol/l, mientras que en soluciones alcalinas es inferior a 10 -7 mol/l.
