En el caso de las reacciones químicas, la conversión completa de sustratos en productos se observa solo para una pequeña parte de ellos. La gran mayoría, incluidas las que se producen en nuestro organismo, son reversibles. Para tales procesos, se establece un estado de equilibrio químico. Este es un concepto extremadamente importante en química, que está asociado, por ejemplo, con el principio de Le Chatelier (o la Ley del Equilibrio). El conocimiento de las leyes y principios básicos relacionados con el equilibrio químico permite, por ejemplo, predecir muchas reacciones o realizar procesos tecnológicos de manera más eficiente.
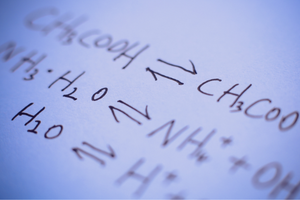
Reacciones reversibles e irreversibles.
Teniendo en cuenta el curso de las reacciones químicas, se puede hacer una división general: en reacciones reversibles e irreversibles. Sin embargo, debe recordarse que en realidad no existen reacciones 100%irreversibles, y la calificación a un grupo en particular se basa en el efecto final prevaleciente.
Reacciones irreversibles
En este caso, los sustratos del sistema reaccionan y dan como resultado productos específicos. Sin embargo, no hay transformación inversa: productos en sustratos . En la fórmula, se marca una sola flecha entre los reactivos y la flecha apunta hacia los productos. Las reacciones irreversibles son principalmente todas aquellas en las que se forman precipitados. En la práctica, son insolubles en agua y no pueden reconstituirse. La reversibilidad del proceso también es difícil de lograr en el caso de reacciones que tienen lugar en sistemas abiertos, es decir, en un vaso de precipitados o un matraz esférico, de los cuales uno de los productos resultantes, por ejemplo, dióxido de carbono, puede escapar libremente, pero cambiando las condiciones. de la reacción, es decir, transfiriéndola a un sistema cerrado, puede hacerse reversible. El grupo de reacciones irreversibles también incluye todos los procesos donde la interacción entre las moléculas del producto ocurre en un grado mucho menor que entre los sustratos. Así, tal proceso tiene lugar en ambas direcciones, pero debido a que la reconstitución de los sustratos es despreciable, en la práctica se clasifican como reacciones irreversibles.
Reacciones reversibles
Estas son reacciones en las que se forman productos a partir de sustratos y, al mismo tiempo, ocurre el proceso inverso con una intensidad comparable, es decir, la reconstitución de sustratos a partir de productos. En la fórmula de reacción, se colocan dos flechas entre los reactivos, con las flechas apuntando en direcciones opuestas, para indicar la reversibilidad de las reacciones que tienen lugar. Las reacciones reversibles son principalmente aquellas que se llevan a cabo en sistemas cerrados. Las moléculas de sustratos y productos no pueden salir del ambiente de reacción y chocan entre sí, creando productos y reconstituyendo sustratos. Un ejemplo de tal reacción es la producción de yoduro de hidrógeno a partir de yodo e hidrógeno.
El estado de equilibrio químico.
Que una reacción particular pueda ocurrir, o si es reversible o irreversible, depende en gran medida de las condiciones particulares del proceso y del tipo de proceso. Si tiene lugar una reacción reversible, es decir, los sustratos se transforman en productos como resultado de una reacción química y, al mismo tiempo, como resultado de las colisiones de las moléculas del producto, los sustratos experimentan una recreación, entonces, en algún momento cuando ocurren estas reacciones, se establece un estado de equilibrio químico . En otras palabras, las concentraciones de sustratos y productos en el sistema están en un nivel constante, su cantidad no cambia a pesar de la reacción continua. En el estado de equilibrio químico, las velocidades de reacción en ambas direcciones son las mismas. El equilibrio químico, bajo ciertas condiciones, significa el estado más estable para un sistema particular. El requerimiento de energía es entonces muy bajo. La constante de equilibrio químico, K , es un coeficiente que describe el equilibrio de dos reacciones reversibles. Se define como el cociente de las concentraciones de productos y sustratos elevados a las potencias correspondientes a los coeficientes estequiométricos que se midieron en estado de equilibrio químico. La fórmula de la constante se derivó en 1864 como la llamada ley de acción de masas. Debe recordarse que este es un valor característico para una reacción particular. Una serie de factores afectan el estado de equilibrio químico. Estos son algunos de ellos:
- Temperatura,
- volumen del sistema de reacción,
- presión,
- concentración de reactivos.
Lo que es importante, la posición del estado de equilibrio no se ve afectada por la adición o cambio del catalizador de reacción. Su tarea es solo acortar el tiempo durante el cual se alcanza el equilibrio. 
El principio de Le Chatelier (la ley del equilibrio)
Al cambiar ciertas condiciones de reacción, podemos influir en su equilibrio. El sistema siempre se esforzará por mantener el equilibrio, porque energéticamente le es favorable (menor gasto de energía). Como consecuencia, habrá cambios que contrarresten los factores que desequilibran el sistema. Este fenómeno fue explicado en 1881 y se conoce hoy como el principio de Le Chatelier-Braun o como la Ley del Equilibrio. Permite comprender la respuesta del sistema ante cambios en las condiciones de una reacción, que se encuentra en estado de equilibrio químico. La adición de una de las sustancias que reaccionan al sistema provoca una perturbación del equilibrio. Las concentraciones de los reactivos individuales cambian. Así, para contrarrestar esto, el sistema tiende a producir más producto (cuando se ha añadido un sustrato) oa reconstituir el sustrato (cuando se ha añadido una cierta cantidad de producto). Cambiar la temperatura de reacción tiene un gran impacto, especialmente para los procesos endotérmicos y exotérmicos. En el caso de los primeros, es necesario aportar energía al sistema en forma de calor, por lo que al aumentar la temperatura de todo el proceso se desplazará el equilibrio hacia la derecha (bajando hacia la izquierda), hacia la formación de más producto. . Lo contrario será el caso de las reacciones exotérmicas, donde uno de los productos es el calor. La temperatura no tiene efecto sobre el equilibrio de la reacción, donde no se observa ningún efecto térmico. En el caso de reacciones que tienen lugar en fase gaseosa, la presión es un aspecto muy importante. El aumento del valor de este parámetro, es decir, la reducción del volumen de reacción del sistema, hará que se desplace el equilibrio de la reacción. La dirección de los cambios depende de los coeficientes estequiométricos en la ecuación de reacción. Este parámetro no afectará el equilibrio químico de la reacción en la que la suma de los coeficientes estequiométricos de los sustratos y productos gaseosos es la misma. Vale la pena recordar que cuando el sistema sale del equilibrio químico, se aplicará la Ley del Equilibrio y, como resultado, se alcanzará un nuevo estado de equilibrio.
