Los métodos espectroscópicos son un grupo de métodos en los que la señal se produce mediante la interacción de radiación electromagnética o corpuscular con la muestra examinada. Esta radiación puede surgir como resultado de cambios periódicos en el campo electromagnético asociados con la transferencia de energía. Estos métodos se utilizan para determinar la concentración o el contenido de átomos en un sistema absorbente o emisor determinado. ¿Qué tipos de espectrofotometría existen y en qué consisten estos métodos? Esto es lo que descubrirá en nuestro artículo.

Transiciones de radiación y energía.
La propiedad más importante de los fotones, o cuantos de radiación, es la energía. La fórmula para el valor de la energía (E) es el producto de la constante de Planck (h) de 6.626·10 -34 [J ·s] y la frecuencia de radiación (v) expresada en Hercios [Hz]. 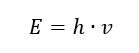 La espectrofotometría hace uso de transiciones de energía en las moléculas, provocadas por la absorción o emisión de radiación electromagnética en diferentes rangos:
La espectrofotometría hace uso de transiciones de energía en las moléculas, provocadas por la absorción o emisión de radiación electromagnética en diferentes rangos:
- ultravioleta (UV) 200-380 nm,
- radiación visible (Vis) 380-780 nm,
- infrarrojo cercano (IR) 0,78-30000 μm.
Conceptos básicos y leyes de la espectrofotometría.
punto isosbéstico
Este es el punto correspondiente a una longitud de onda específica resultante de la intersección de curvas trazadas en el sistema absorbancia-longitud de onda, donde ambas formas del compuesto en solución (disociadas y no disociadas) tienen igual absorción. Un cambio de pH no cambia la posición; un compuesto puede tener muchos de esos puntos.
Espectro de absorción de un compuesto químico.
El espectro es una medida de la cantidad de luz absorbida por el compuesto a partir de la longitud de onda de la luz (λ). Si una radiación electromagnética (luz) de intensidad I 0 incide sobre una muestra, parte de esta radiación será absorbida y otra parte atravesará la muestra. Al registrar las intensidades de la radiación incidente (I 0 ) y transmitida (I t ), podemos determinar la cantidad de luz que absorbe la solución (absorbancia, A) o que ha pasado a través de ella (transmitancia, T).
absorbancia
La cantidad que describe el fenómeno de la absorción es la absorbancia. Esta es una medida adimensional de la intensidad de la radiación electromagnética en relación con el número de átomos libres. Esta cifra se introdujo para facilitar los cálculos relacionados con los volúmenes de absorción. La absorción es la interacción entre la radiación electromagnética y la materia: la absorción de parte de la energía por la materia. La absorbancia es aditiva y a veces se la denomina densidad óptica. Simbólicamente, se registra como Abs o A. Matemáticamente, es el logaritmo decimal de la relación entre la intensidad del haz de radiación que incide sobre la muestra de prueba (I 0 ) y la intensidad del haz de radiación transmitida a través de la muestra de prueba. ( Él ). Puede tomar valores desde 0 hasta infinito. La expresión matemática que describe esta relación se llama ley de Beer-Lambert. La absorbancia a una longitud de onda determinada depende del coeficiente de absorción (ε), el espesor de la capa absorbente (normalmente 1 cm) y la concentración de la solución problema.
Transmitancia
La transmitancia es la relación entre la irradiancia que pasa a través de la muestra (I t ) y la irradiancia incidente sobre la muestra (I 0 ), que es igual a la irradiancia que pasa a través de la referencia. Generalmente se expresa como porcentaje y puede oscilar entre 0%y 100%. Se expresa mediante la fórmula: 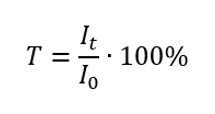 La relación entre absorbancia y transmitancia se expresa de la siguiente manera:
La relación entre absorbancia y transmitancia se expresa de la siguiente manera: 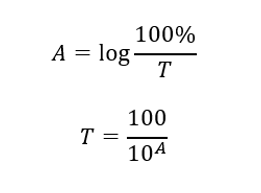
Ley de Lambert
Dice que la absorbancia es proporcional al espesor de la capa absorbente de una muestra homogénea. Puede registrarse como el cociente del coeficiente de absorción (k) y el espesor de la capa de muestra medida (l): 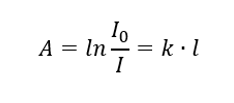

Ley de Beer-Lambert
Se refiere a la absorción de radiación por soluciones y se puede formular de la siguiente manera: si el coeficiente de absorción del disolvente es cero, entonces la absorbancia de un haz de radiación monocromática que pasa a través de una solución homogénea es directamente proporcional a la concentración (c) de la solución. y al espesor de la capa absorbente (l). La ley de Beer-Lambert es la definición de absorbancia y se puede escribir de la siguiente manera: 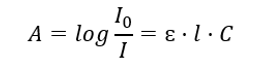 El coeficiente de absorción molar (ɛ) es un valor característico de una sustancia en un disolvente particular y a una longitud de onda particular. Es proporcional a la probabilidad de transiciones entre los niveles de energía de la molécula y depende directamente de la energía de los fotones de radiación. En términos numéricos representa la absorbancia que presenta una solución con una concentración de 1 mol/dm 3 , con un espesor de capa absorbente de 1 cm. Conocer el coeficiente permite determinar la concentración de la solución de prueba después de medir la magnitud de la absorbancia. Opcionalmente, la absorbancia esperada de la solución también se puede calcular a partir del coeficiente y la concentración. La fórmula se utiliza principalmente para determinar la concentración de una sustancia con un coeficiente de absorción molar conocido y una absorbancia medida empíricamente. Esto se puede hacer usando una fórmula o dibujando una curva de calibración para la sustancia en varios puntos en el rango de concentración esperada. La ley de Beer-Lambert también se puede presentar como dependencia de la concentración de la absorción: A = f(C).
El coeficiente de absorción molar (ɛ) es un valor característico de una sustancia en un disolvente particular y a una longitud de onda particular. Es proporcional a la probabilidad de transiciones entre los niveles de energía de la molécula y depende directamente de la energía de los fotones de radiación. En términos numéricos representa la absorbancia que presenta una solución con una concentración de 1 mol/dm 3 , con un espesor de capa absorbente de 1 cm. Conocer el coeficiente permite determinar la concentración de la solución de prueba después de medir la magnitud de la absorbancia. Opcionalmente, la absorbancia esperada de la solución también se puede calcular a partir del coeficiente y la concentración. La fórmula se utiliza principalmente para determinar la concentración de una sustancia con un coeficiente de absorción molar conocido y una absorbancia medida empíricamente. Esto se puede hacer usando una fórmula o dibujando una curva de calibración para la sustancia en varios puntos en el rango de concentración esperada. La ley de Beer-Lambert también se puede presentar como dependencia de la concentración de la absorción: A = f(C).
Ley de aditividad
La ley de Beer-Lambert se refiere al caso en el que hay una sustancia absorbente en solución. Sin embargo, si en una solución multicomponente hay más sustancias que absorben radiación en una longitud de onda seleccionada, la absorbancia de esta solución (A) es igual a la suma de las absorbancias de sus componentes individuales (A 1 , A 2 ,…), es decir A=A 1 +A 2 +⋯+A n . Vale la pena señalar y recordar que la absorbancia de cada componente es el producto de su concentración y el correspondiente coeficiente de absorción molar. Esta es la tercera ley de absorción, utilizada en el análisis espectrofotométrico de sistemas multicomponente.
Desviaciones de las leyes de absorción.
Un requisito previo para cumplir las leyes de la absorción es que la radiación que actúa sobre el sistema sea monocromática y que su intensidad no sea demasiado alta. Las razones para desviarse de la ley de Beer-Lambert pueden ser:
- imperfección de los instrumentos de medida, que da lugar a que no se cumpla la condición,
- reacciones químicas que ocurren durante la medición, por ejemplo polimerización , hidrólisis, condensación,
- turbidez de la solución.
Aplicación de espectros de absorción de electrones.
- Permite determinar el tipo de transiciones electrónicas examinando espectros en disolventes de diferente polaridad.
- Las diferencias en la posición e intensidad de las bandas de absorción de las distintas formas moleculares se utilizan para estudiar los equilibrios que se establecen entre ellas en la solución ( estudios estructurales , equilibrios tautoméricos).
- Se utiliza para la determinación de compuestos según la ley de Beer-Lamber.
- Se utiliza como método de identificación adicional basado en la posición λ max de las sustancias de prueba.
- Se utiliza en la determinación de la pureza de los compuestos de prueba: cambiando la posición máxima de absorción, comparando la relación de los valores de absorbancia en dos puntos diferentes del espectro.

Espectroscopia electrónica UV-Vis
En cuanto al fenómeno de la absorción, la espectrofotometría UV-Vis es una técnica especialmente interesante que permite el análisis cualitativo y cuantitativo de muchas sustancias. El fenómeno de absorción de radiación se utiliza cuando: la absorción depende linealmente de la concentración o cuando la absorción es aditiva, es decir, para una solución multicomponente es la suma de las absorciones de sus componentes. Las condiciones se cumplen cuando no hay interacciones intermoleculares en el sistema. Al analizar los espectros de absorción UV-Vis resultantes del paso de radiación electromagnética a través de la solución, se observan las transiciones de los electrones de valencia del estado terrestre al estado excitado. Este fenómeno provoca la absorción de parte de la radiación en determinadas longitudes de onda. La absorción es la consecuencia de la transición de estos electrones a niveles de energía superiores, pero para que esto suceda, los cuantos de radiación electromagnética deben tener suficiente energía para equilibrar la diferencia de energía entre los niveles de energía. En las moléculas, estas energías son de unos pocos electronvoltios, lo que corresponde exactamente a la frecuencia UV-Vis.
cromóforos
Los compuestos que muestran absorción en el rango UV-Vis tienen en su estructura cromóforos, es decir, grupos de átomos cuyos electrones se caracterizan por tener bajas energías de excitación. En otras palabras, un cromóforo es la parte de una molécula (grupo de átomos) responsable de la absorción selectiva de la radiación en el rango visible (180-800 nm) y, por tanto, de la aparición del color. Estos incluyen: anillos aromáticos (sexteto de electrones aromáticos), enlaces múltiples (parte de ellos – enlaces tipo π), tanto entre átomos de carbono como otros, como el grupo carbonilo C=O.
auxocromos
Otro grupo de átomos son los auxocromos, es decir, sustituyentes que no muestran absorción en el rango UV-Vis, pero su presencia provoca cambios en los espectros de los elementos absorbentes. Potencian la acción de los cromóforos, lo que a menudo podemos observar en forma de una coloración mucho más intensa de la sustancia problema que en caso de su ausencia en el sistema. Además, dividimos los auxocromos en batocromos , por ejemplo –NH 2 , -OH, que desplazan el máximo de absorción hacia longitudes de onda más largas, e hipsocromos , como –CH 3 , -CO, que desplazan el máximo hacia longitudes de onda más cortas.
Espectroscopia de absorción atómica (AAS)
Esta es otra técnica que utiliza el fenómeno de la absorción. Se utiliza para determinar elementos químicos en forma de muestras en cualquier estado (líquido, sólido, gaseoso) y la medición en sí se basa en observar la absorción de radiación de una longitud de onda específica por los átomos metálicos libres. La base de la técnica es que un átomo sólo puede absorber radiación electromagnética en una longitud de onda en la que también puede emitirla, y esto es característico sólo del elemento en cuestión. Con mayor energía suministrada al átomo, los electrones se excitan a niveles más altos y se observa una mayor cantidad de líneas en el espectro. Si la energía suministrada corresponde al potencial de ionización del átomo, se forman iones como el Na + . La base para el análisis cuantitativo mediante espectrometría de absorción atómica es la proporcionalidad de la absorbancia al número de átomos absorbentes y la ley de Beer-Lambert.
