La estequiometría es la rama de la química general que se ocupa de los cálculos relativos al curso cuantitativo de las reacciones químicas. Cuando se trabaja en el laboratorio, muchas veces es necesario saber qué cantidad (masa, volumen, moléculas) de sustrato necesitamos utilizar para que la reacción química que estamos llevando a cabo se lleve a cabo por completo o para obtener la cantidad de producto. queremos. A veces también es necesario calcular el exceso o la falta de sustrato que provocó que el experimento se desarrollara de manera diferente a lo esperado. Cada uno de estos cálculos se deriva directamente de la interpretación cuantitativa de la ecuación de reacción química y utiliza las leyes de conservación de la masa. Este tipo de ecuaciones se denominan cálculos estequiométricos.

Que necesitamos saber?
Para utilizar la estequiometría, necesitamos tener conocimientos en varias áreas, que incluyen: ecuaciones de reacciones químicas, coeficientes estequiométricos, moles y masas molares y volúmenes molares de gases y la ley de Avogadro . Utilizando el conocimiento de la estequiometría de las reacciones químicas, se pueden resolver muchos problemas de cálculo, como por ejemplo:
- análisis elemental,
- cálculos molares,
- cálculos de masa,
- cálculo de mezclas no estequiométricas con posibilidad de determinar la sustancia limitante en la reacción,
- rendimiento de la reacción.
Masa molar
Debido a la masa inconcebiblemente pequeña de los átomos y moléculas individuales, se creó la unidad (u) , que expresa la masa atómica. En la práctica, este es un valor igual a 1/12 de la masa del isótopo de carbono 12 C. Esta porción de una sustancia está estrechamente relacionada con la constante de Avogadro y se determina como la cantidad de gramos de una sustancia que contiene 6,022·10. 23 átomos, moléculas o iones. La masa molar [M] es numéricamente igual a la masa atómica o molecular , y la unidad es g/mol.
Volumen molar de sustancia [Vm]
Se trata de un valor específico de cada sustancia que depende en gran medida de las condiciones de temperatura y presión. Este es el volumen de la sustancia que ocupa un mol de la misma. En condiciones normales se adopta un valor constante de 22,4 dm 3 .
Ley de composición constante y conservación de la masa.
Todo compuesto químico, independientemente de su origen y método de obtención, tiene una composición cualitativa y cuantitativa bien definida y constante. El óxido de azufre (IV), por ejemplo, siempre contiene un 50%en peso de azufre y el óxido de azufre (VI) un 40%en peso de este elemento. En un sistema cerrado, la masa de los productos resultantes es igual a la masa de los sustratos consumidos durante la reacción. La ley de conservación de la masa se refleja en la necesidad de equilibrar cada ecuación de reacción química con los coeficientes químicos apropiados para que los dos lados de la ecuación sean iguales en términos del número de átomos presentes. Las relaciones estequiométricas reflejan las relaciones molares de los reactivos presentes en la reacción química.
Ecuación de reacción química
Toda la información necesaria sobre las relaciones relativas entre sustancias químicas se deriva de su ecuación de reacción química. Proporciona información relativa y cuantitativa importante.
Ejemplo 1.
De la ecuación para la síntesis de amoníaco , que sigue la reacción: ![]() Podemos realizar varias interpretaciones: molecular, molar, masas molares, volúmenes molares y números moleculares. a) Molecularmente, podemos leer que tres moléculas de hidrógeno reaccionan con una molécula de nitrógeno para formar dos moléculas de amoníaco. b) Esto también significa que tres moles de hidrógeno reaccionan con un mol de nitrógeno para formar el producto de dos moles de amoníaco. c) Utilizando la tabla periódica de elementos químicos , que contiene las masas molares de los átomos individuales, también podemos concluir de la ecuación que 6 g de hidrógeno reaccionaron completamente con 28 g de nitrógeno para formar 34 g de amoníaco. d) Entonces, suponiendo condiciones normales, sabemos que un mol de gas ocupa 22,4 dm 3 . Esto nos permite concluir que 67,2 dm 3 de hidrógeno reaccionan con 22,4 dm 3 de nitrógeno para formar 44,8 dm 3 de amoníaco. e) Otra relación útil es la ley de Avogadro, que establece que volúmenes iguales de diferentes gases contienen el mismo número de partículas en las mismas condiciones de presión y temperatura. Conociendo la constante de Avogadro de 6.022·10 23 , sabemos que necesitamos 3·6.022·10 23 moléculas de hidrógeno y 6.022·10 23 moléculas de nitrógeno para llevar a cabo la reacción química completa de síntesis de amoniaco. La reacción produce 2·6,022·10 23 moléculas de amoníaco.
Podemos realizar varias interpretaciones: molecular, molar, masas molares, volúmenes molares y números moleculares. a) Molecularmente, podemos leer que tres moléculas de hidrógeno reaccionan con una molécula de nitrógeno para formar dos moléculas de amoníaco. b) Esto también significa que tres moles de hidrógeno reaccionan con un mol de nitrógeno para formar el producto de dos moles de amoníaco. c) Utilizando la tabla periódica de elementos químicos , que contiene las masas molares de los átomos individuales, también podemos concluir de la ecuación que 6 g de hidrógeno reaccionaron completamente con 28 g de nitrógeno para formar 34 g de amoníaco. d) Entonces, suponiendo condiciones normales, sabemos que un mol de gas ocupa 22,4 dm 3 . Esto nos permite concluir que 67,2 dm 3 de hidrógeno reaccionan con 22,4 dm 3 de nitrógeno para formar 44,8 dm 3 de amoníaco. e) Otra relación útil es la ley de Avogadro, que establece que volúmenes iguales de diferentes gases contienen el mismo número de partículas en las mismas condiciones de presión y temperatura. Conociendo la constante de Avogadro de 6.022·10 23 , sabemos que necesitamos 3·6.022·10 23 moléculas de hidrógeno y 6.022·10 23 moléculas de nitrógeno para llevar a cabo la reacción química completa de síntesis de amoniaco. La reacción produce 2·6,022·10 23 moléculas de amoníaco.
Ejemplo 2.
La reacción de combustión del magnesio en cloro ocurre según la ecuación: ![]() nos permite llegar a interpretaciones similares al ejemplo anterior. a) Incluso a primera vista, la ecuación presentada nos permite concluir que, para obtener una molécula de cloruro de magnesio , debemos suministrar como sustratos una molécula de magnesio y una molécula de cloro. b) Esto es, por supuesto, equivalente al número de moles presentes en el sistema, es decir, un mol de magnesio, un mol de cloro, un mol de cloruro de magnesio. c) Para los cálculos de masa, sabemos que 24 g de magnesio reaccionan con 71 g de cloro para formar 95 g de cloruro de magnesio. d) Dado que en la reacción química considerada sólo interviene un gas, el cloro , también podemos escribir que ocupa un volumen de 22,4 dm 3 . e) En el recuento de partículas, cada componente es igual al otro y toma el valor 6,022·10 23 .
nos permite llegar a interpretaciones similares al ejemplo anterior. a) Incluso a primera vista, la ecuación presentada nos permite concluir que, para obtener una molécula de cloruro de magnesio , debemos suministrar como sustratos una molécula de magnesio y una molécula de cloro. b) Esto es, por supuesto, equivalente al número de moles presentes en el sistema, es decir, un mol de magnesio, un mol de cloro, un mol de cloruro de magnesio. c) Para los cálculos de masa, sabemos que 24 g de magnesio reaccionan con 71 g de cloro para formar 95 g de cloruro de magnesio. d) Dado que en la reacción química considerada sólo interviene un gas, el cloro , también podemos escribir que ocupa un volumen de 22,4 dm 3 . e) En el recuento de partículas, cada componente es igual al otro y toma el valor 6,022·10 23 . 
Rendimiento porcentual de la reacción química [ %W]
Los cálculos estequiométricos también se utilizan para determinar el rendimiento de una reacción, es decir, la relación entre la cantidad real de producto obtenido y la cantidad derivada de la ecuación de la reacción química.
Ejemplo 1.
Se llevó a cabo la reacción de oxidación de 30 kg de óxido de azufre (IV) y, en presencia de un catalizador de platino, se obtuvo el producto de 34 kg de óxido de azufre (VI). ¿Cuál fue el rendimiento de este proceso? Ecuación de reacción química: ![]() De la reacción registrada, podemos ver que dos moles de óxido de azufre (IV) producen la misma cantidad de moles de óxido de azufre (VI). Conociendo las masas molares de los reactivos, sabemos que estequiométricamente, suponiendo un rendimiento del 100%, 128 g de SO 2 producen 160 g de SO 3 . Con este conocimiento, podemos ordenar la relación: 0,128 kg SO 2 – 0,160 kg SO 3 30 kg SO 2 – x kg SO 3 A partir de aquí averiguaremos la cantidad de óxido de azufre (VI) que se produciría al 100 por ciento. producir.
De la reacción registrada, podemos ver que dos moles de óxido de azufre (IV) producen la misma cantidad de moles de óxido de azufre (VI). Conociendo las masas molares de los reactivos, sabemos que estequiométricamente, suponiendo un rendimiento del 100%, 128 g de SO 2 producen 160 g de SO 3 . Con este conocimiento, podemos ordenar la relación: 0,128 kg SO 2 – 0,160 kg SO 3 30 kg SO 2 – x kg SO 3 A partir de aquí averiguaremos la cantidad de óxido de azufre (VI) que se produciría al 100 por ciento. producir. 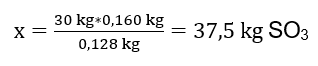 Conociendo la cantidad teórica y real de SO 3 , podemos calcular el rendimiento con el que se produjo la reacción. 37,5 kg SO 3 – 100 %de rendimiento 34 kg SO 3 – x %de rendimiento
Conociendo la cantidad teórica y real de SO 3 , podemos calcular el rendimiento con el que se produjo la reacción. 37,5 kg SO 3 – 100 %de rendimiento 34 kg SO 3 – x %de rendimiento 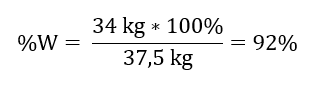 La oxidación de óxido de azufre (IV) a óxido de azufre (VI) utilizando un catalizador de platino se produjo con un rendimiento del 92 %.
La oxidación de óxido de azufre (IV) a óxido de azufre (VI) utilizando un catalizador de platino se produjo con un rendimiento del 92 %.
Fórmulas moleculares y elementales.
Otra aplicación de los cálculos estequiométricos es determinar las fórmulas de compuestos químicos simples. La fórmula molecular de un compuesto químico es idéntica o múltiplo entero de la fórmula empírica. Si sabemos que la fórmula general de un compuesto químico es N x O y , los valores de los índices estequiométricos se pueden calcular dividiendo la masa de los átomos entre sus masas atómicas. Si no se conoce el peso molecular de un compuesto químico, sino sólo su composición porcentual, sólo se puede dar la fórmula elemental. Puede ser una representación fiel de la fórmula molecular o simplemente determinar la proporción de los elementos individuales.
Ejemplo 1.
El peso molecular del compuesto químico es 92 u y se compone de 30,43 %de nitrógeno y 69,57 %de oxígeno. ¿Cuál es la fórmula molecular del compuesto químico? Dado que la suma de las moléculas presentes en el compuesto es 100%, podemos suponer que: 92 u – 100%. Esto nos permite calcular los contenidos elementales individuales: 92 u – 100%xu de nitrógeno – 30,43%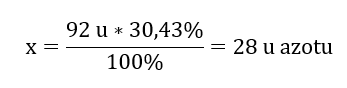 Por tanto sabemos que la masa por átomo de oxígeno es: 92 u – 28 u = 64 u Conociendo las masas individuales de los elementos, podemos determinar los índices estequiométricos:
Por tanto sabemos que la masa por átomo de oxígeno es: 92 u – 28 u = 64 u Conociendo las masas individuales de los elementos, podemos determinar los índices estequiométricos: 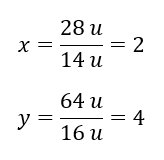 La fórmula molecular de este compuesto químico es N 2 O 4 .
La fórmula molecular de este compuesto químico es N 2 O 4 .
Ejemplo 2.
Hay dos elementos en el compuesto químico: oxígeno al 60%y 40 %de azufre. ¿Cuál es su fórmula elemental? La fórmula general es S x O y , donde x es 40%e y es 60%. Conociendo las masas molares de los elementos individuales, esto se puede representar de la siguiente manera: 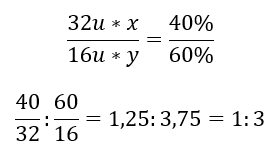 Esto significa que en el compuesto químico dado, hay tres átomos de oxígeno por cada átomo de azufre. La fórmula elemental es SO 3 .
Esto significa que en el compuesto químico dado, hay tres átomos de oxígeno por cada átomo de azufre. La fórmula elemental es SO 3 . 
Exceso y sustrato limitante
En el caso de reacciones en las que los reactivos están presentes en proporciones divergentes de su estequiometría correspondiente, uno de los reactivos reaccionará completamente y la reacción se detendrá. Luego está presente en la forma de reactivo limitante, mientras que el segundo reactivo estará en el sistema en exceso y también seguirá presente en el sistema en su forma primaria cuando se complete la reacción.
Ejemplo 1.
En el laboratorio, se hicieron reaccionar 40 cm 3 de una solución de sulfato de aluminio 0,25 M con 50 cm 3 de una solución de cloruro de bario 0,5 M. ¿Cuántos gramos de precipitado se formarán? Ecuación de reacción química: ![]() El primer paso para conocer el curso real de una reacción es determinar el número real de moles de las sustancias involucradas en la reacción. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 dm 3 = 0,010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 dm 3 = 0,025 mol El segundo paso es para determinar el sustrato deficitario en función de la estequiometría de la reacción; esto determinará la cantidad de precipitado formado. 1 mol Al 2 (SO 4 ) 3 – 3 mol BaCl 2 0,010 mol Al 2 (SO 4 ) 3 – x mol BaCl 2
El primer paso para conocer el curso real de una reacción es determinar el número real de moles de las sustancias involucradas en la reacción. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 dm 3 = 0,010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 dm 3 = 0,025 mol El segundo paso es para determinar el sustrato deficitario en función de la estequiometría de la reacción; esto determinará la cantidad de precipitado formado. 1 mol Al 2 (SO 4 ) 3 – 3 mol BaCl 2 0,010 mol Al 2 (SO 4 ) 3 – x mol BaCl 2 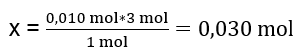 Para llevar a cabo la reacción completamente, teniendo 0,010mol Al 2 (SO 4 ) 3 , es necesario agregar al sistema 0,030 mol BaCl 2 . Sin embargo, sólo reaccionan 0,025 moles de cloruro de bario, lo que significa que hay un déficit y limitará la reacción. Por tanto, la cantidad de precipitado formado en la reacción debe calcularse a partir de la cantidad de este sustrato. El número de moles de cloruro de bario utilizados según la estequiometría de la reacción es igual al número de moles del precipitado formado, así: n BaSO4 = n BaCl2 0.025mol BaSO 4 = 0.025mol BaCl 2 Conociendo el número de moles de bario sulfato, podemos calcular su masa: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025mol · 233,393 g/mol = 5,835g Las reacciones y cantidades de sustratos dadas en la tarea producen 5,835g de precipitado de sulfato de bario.
Para llevar a cabo la reacción completamente, teniendo 0,010mol Al 2 (SO 4 ) 3 , es necesario agregar al sistema 0,030 mol BaCl 2 . Sin embargo, sólo reaccionan 0,025 moles de cloruro de bario, lo que significa que hay un déficit y limitará la reacción. Por tanto, la cantidad de precipitado formado en la reacción debe calcularse a partir de la cantidad de este sustrato. El número de moles de cloruro de bario utilizados según la estequiometría de la reacción es igual al número de moles del precipitado formado, así: n BaSO4 = n BaCl2 0.025mol BaSO 4 = 0.025mol BaCl 2 Conociendo el número de moles de bario sulfato, podemos calcular su masa: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025mol · 233,393 g/mol = 5,835g Las reacciones y cantidades de sustratos dadas en la tarea producen 5,835g de precipitado de sulfato de bario.
