En química, algunos compuestos químicos forman enlaces especiales con moléculas de agua. No se trata de enlaces químicos, sino de interacciones de corto alcance que determinan específicamente las propiedades de estos compuestos. Estamos hablando de hidratos. Sus propiedades se utilizan fácilmente en sectores industriales seleccionados. La sal hidratada más popular es sin duda el yeso o sulfato de calcio dihidrato (VI), que es una importante materia prima en la industria de la construcción. Los hidratos también son muy buenos indicadores del contenido de humedad. Esto está relacionado con el hecho de que el color de la sal anhidra suele ser diferente al de la sal hidratada.

Hidrata
Los hidratos no son compuestos químicos en los que se producen enlaces químicos , como enlaces covalentes , entre las moléculas de agua y las moléculas de la sal dada . Tampoco son compuestos de coordinación. La formación de enlaces de hidrógeno, que tienen una fuerza mucho más débil que los enlaces químicos, es característica de estas estructuras. Los hidratos están estructurados en forma de red cristalina. Las moléculas de agua se encuentran distribuidas irregularmente en él. A menudo se utiliza el término “agua de cristalización”. Los hidratos se obtienen por hidratación . Las moléculas de sal, especialmente los derivados de ácidos inorgánicos, son las que tienen más probabilidades de sufrir esta reacción. La hidratación implica la transformación de cristales anhidros en hidratados. Puede provocar un cambio en la masa mineral, pero no la destruye. La hidratación suele acompañar a otros procesos, como la carbonatación. Los productos químicos de hidratación, en condiciones normales, se caracterizan por una alta higroscopicidad , es decir, una fuerte afinidad por las moléculas de agua. Estas sustancias son capaces, por ejemplo, de absorber la humedad del aire . Otra forma de obtener hidratos es cristalizarlos en soluciones acuosas. Las fórmulas moleculares de los hidratos se forman escribiendo la fórmula de la sal y indicando el número de moléculas de agua hidratadas. Para proporcionar una notación general, la letra ‘n’ se coloca antes de ‘H 2 O’. Sus valores son mayores que uno y corresponde al número de moléculas de agua adheridas. Las distinciones más comunes son entre hidratos con n=½ (hemihidrato), n= 1 (monohidrato), n=2 (dihidrato) y n=3 (trihidrato). Es importante destacar que la misma sustancia puede unir diferentes números de moléculas de agua. ![]()
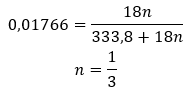 Dado que existen enlaces de hidrógeno entre las moléculas de sal y las moléculas de agua, estos compuestos no muestran una resistencia satisfactoria a las temperaturas elevadas. Cuando se calientan, se desintegran y cambian a formas anhidras. Los hidratos se disuelven muy bien en agua. En soluciones acuosas se liberan moléculas de agua hidratadas unidas a la sal. Este hecho debe tenerse en cuenta, por ejemplo, al preparar soluciones de estas sustancias. No tener en cuenta el grado de hidratación de un compuesto determinado da lugar a errores, aunque sólo sea en la determinación de la concentración de la solución. Una característica importante de las sales hidratadas es el cambio de color debido a la unión de moléculas de agua en la reacción de hidratación. Cabe señalar que las formas hidratadas muestran una higroscopicidad significativamente menor en comparación con las sales anhidras.
Dado que existen enlaces de hidrógeno entre las moléculas de sal y las moléculas de agua, estos compuestos no muestran una resistencia satisfactoria a las temperaturas elevadas. Cuando se calientan, se desintegran y cambian a formas anhidras. Los hidratos se disuelven muy bien en agua. En soluciones acuosas se liberan moléculas de agua hidratadas unidas a la sal. Este hecho debe tenerse en cuenta, por ejemplo, al preparar soluciones de estas sustancias. No tener en cuenta el grado de hidratación de un compuesto determinado da lugar a errores, aunque sólo sea en la determinación de la concentración de la solución. Una característica importante de las sales hidratadas es el cambio de color debido a la unión de moléculas de agua en la reacción de hidratación. Cabe señalar que las formas hidratadas muestran una higroscopicidad significativamente menor en comparación con las sales anhidras.
Hidratos de compuestos inorgánicos.
Las sales de ácidos inorgánicos son sustancias que tienen, con diferencia, la mayor probabilidad de formar hidratos con moléculas de agua. Los hidratos de compuestos inorgánicos más comunes incluyen:
- Sulfato de cobre (II) hidratado (VI), CuSO 4 – el sulfato de cobre (II) (VI) adopta varios grados de hidratación. El número máximo de moléculas de agua unidas es cinco. Como resultado del calentamiento del pentahidrato de esta sal, se desprenden las moléculas de agua. Se forman los primeros dos y un trihidrato y, al seguir calentando el sistema, se puede obtener sulfato de cobre (II) monohidrato (VI). Para eliminar la última molécula de agua, es necesario calentar el compuesto a una temperatura superior a 200 ᵒC. Los sulfatos de cobre (II) hidratos (VI) son de color azul, causado por la presencia de agua de cristalización alrededor de los iones de cobre. Mientras que la sal anhidra es de color blanco. Su alta higroscopicidad y capacidad para formar hidratos se utiliza para eliminar la humedad de algunos líquidos.
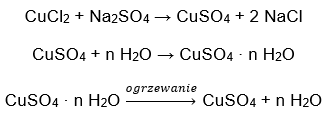
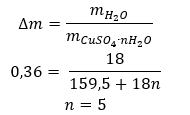
- Hidrato de cloruro de cobalto (II), CoCl 2 : el cloruro de cobalto (II) anhidro es altamente higroscópico. Gracias a su fuerte afinidad por las moléculas de agua, es capaz de absorber humedad incluso del aire. Este proceso da como resultado la formación de hidratos de esta sal. La forma hidratada más común es el hexahidrato de cloruro de cobalto (II): CoCl 2 * 6H 2. Otra forma es la molécula de dihidrato. Esta sal también muestra la capacidad de cambiar de color dependiendo de su contenido de humedad. La sal anhidra es azul, la dihidrato adquiere un color rosado-violeta y el color de la molécula de hexahidrato es rojo intenso.
- Hidrato de sulfato de sodio (VI), Na 2 SO 4 : esta sal existe en forma de dos hidratos: heptahidrato (cinco moléculas de agua en la estructura) y decahidrato (diez moléculas de agua en la estructura). La forma anhidra del sulfato de sodio (VI) se encuentra en la naturaleza como el raro mineral tenardita. El sulfato de sodio diezhidrato (VI) es la llamada sal de Glauber. Se utiliza ampliamente en la producción de vidrio, papel, detergentes para ropa y refrescos. La sal de Glauber es también uno de los ingredientes necesarios para la producción del pigmento azul ultramar. Además, el compuesto tiene un efecto terapéutico sobre el sistema digestivo, debido a sus propiedades laxantes.

Yeso
Un ejemplo de hidrato de sal inorgánico de importancia mundial y amplia aplicación es el yeso. Es un mineral formado por la forma hidratada del sulfato de calcio (VI), CaSO 4 . El yeso cristalino es el dihidrato de esta sal. En condiciones naturales, se forma durante la evaporación del agua salada de lagos y ríos, a temperaturas inferiores a 42ᵒC. El sulfato de calcio anhidro (VI) es anhidrita. También se le conoce como yeso anhidro. El yeso de construcción, por el contrario, es sulfato de calcio hemihidrato (VI). La forma que se obtenga de esta sal depende de la temperatura que prevalezca durante el procesamiento de la roca sedimentaria madre. El yeso utilizado en la construcción suele ser una mezcla de diferentes formas de sal de cal hidratada. 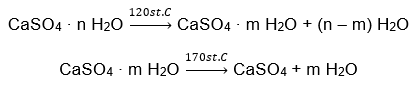
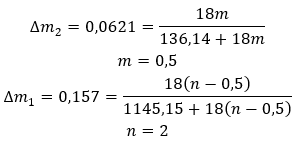 Las posibilidades de aplicación del yeso son muy amplias, especialmente en la industria de la construcción. Los usos más importantes de este hidrato de sal se enumeran a continuación:
Las posibilidades de aplicación del yeso son muy amplias, especialmente en la industria de la construcción. Los usos más importantes de este hidrato de sal se enumeran a continuación:
- En la industria de la construcción, el yeso se utiliza en elementos de acabado. Es uno de los componentes de productos semiacabados a granel, morteros, adhesivos, acabados a base de yeso y componentes de ensamblaje premezclados, por ejemplo, placas de yeso.
- La medicina utiliza yeso para sujetar las extremidades rotas. Los vendajes de yeso se consideran respetuosos con la piel. Además, el material también se utiliza en laboratorios de tecnología dental.
- La industria utiliza yeso en talleres de modelado y diseño. Los moldes de yeso son muy adecuados para dar forma a diversos objetos utilitarios.
- El yeso es un aditivo de algunos fertilizantes utilizados en la agricultura.

Clatratos de metano
Los clatratos de metano pertenecen a un grupo de compuestos conocidos como hidratos de gas. Son responsables de la mayor parte del rápido cambio climático en la historia de la Tierra. Los clatratos de metano también suelen denominarse hidratos de metano o hielo de metano. Forman una forma sólida de agua y metano . Sus moléculas se distinguen por su estructura cristalina. Se forman bajo mayor presión. Toman la forma de sólidos blancos e inodoros, que a menudo son similares, en términos de apariencia externa, al hielo. Curiosamente, al tacto se parecen al poliestireno . Los clatratos son agrupaciones químicas únicas . Las moléculas de agua forman una estructura que se asemeja a una jaula. El metano se almacena dentro de esta jaula. Es importante destacar que ambas sustancias no forman enlaces químicos entre sí. Normalmente, los clatratos de metano constan de 46 moléculas de agua que rodean dos jaulas pequeñas y seis medianas. Las moléculas de metano quedan atrapadas en su interior. También se sabe que los clatratos están formados por 136 moléculas de agua con 16 jaulas pequeñas y ocho grandes de gas metano en su interior. En los últimos años se han descubierto cantidades importantes de este recurso en el fondo de los océanos. Está atrayendo mucho interés debido al potencial de extraer cantidades significativas de metano, que pueden usarse, por ejemplo, con fines energéticos. Los clatratos de metano arden con una llama uniforme y de color rojizo. Después de la quema, queda agua fundida. El metano extraído de esta manera puede ser una buena alternativa a las fuentes convencionales de hidrocarburos , pero también supone una gran amenaza para el clima. Todavía no hay conocimientos suficientes sobre la explotación del metano procedente de los clatratos acumulados en el fondo del océano. La liberación incontrolada de cantidades importantes de este gas puede ser muy peligrosa, ya que aumenta el efecto invernadero mucho más que el dióxido de carbono.
























































































































