El término "elemento" se refiere a los átomos cuyos núcleos contienen un número particular de protones. Aparte de ellos, un núcleo atómico también se compone de otras moléculas: los neutrones. Su número dentro de un solo elemento puede variar. En tal caso, hablamos de isótopos, es decir, variantes de un elemento dado que tienen diferente número de neutrones en su núcleo. Por lo tanto, sus números de masa también son diferentes. Sin embargo, el número atómico permanece constante, ya que el número de electrones en las capas de electrones permanece sin cambios.

Por esta razón, los isótopos de un mismo elemento tienen la misma posición en la tabla periódica y cada uno de ellos tiene el mismo tamaño. Además, sus propiedades químicas y físicas son similares. Sin embargo, hay excepciones donde especialmente las propiedades físicas están más diversificadas, lo que suele ocurrir cuando tratamos con dos isótopos con diferencias significativas en masa. Esto se debe a que es la masa la que determina toda una serie de propiedades como la densidad o la velocidad de difusión de las partículas. En cambio, parámetros como la conductividad eléctrica o el color no dependen de la masa. La diversidad de propiedades químicas normalmente proviene de velocidades de reacción desiguales de varios isótopos.
Nucleidos vs isótopos
Hay un concepto asociado a los isótopos, que es más genérico. Un nucleido es un conjunto completo de átomos cuya estructura nuclear está determinada específicamente por el número de protones y neutrones. Esto significa que dos nucleidos que difieren en el número de neutrones pueden ser isótopos. En la práctica, todos los isótopos son nucleidos, pero no todos los nucleidos son necesariamente isótopos. La idea principal detrás de estos dos conceptos cubre las propiedades químicas en el caso de los isótopos y las propiedades nucleares en el caso de los nucleidos. Por ejemplo:
- Nucleidos que son isótopos:
- Nucleidos que no son isótopos:
Isótopos en la naturaleza
Los elementos químicos existentes en el medio natural son una mezcla de isótopos con una composición porcentual constante. Dependiendo del núcleo, un elemento puede contener uno, varios o más isótopos. Algunos de ellos son estables, pero otros se transforman rápidamente. Tal descomposición puede producir isótopos del mismo elemento o de uno diferente. Tales transiciones suelen ir acompañadas de la emisión de radiación. Para utilizar valores particulares, en la Tierra existen elementos cuyos números atómicos son iguales o inferiores a 92. Aquellos con números hasta 83 se consideran estables. Hay hasta 81 elementos naturales que tienen isótopos estables. Estos incluyen el silicio, con isótopos 28 Si, 29 Si y 30 Si, el hierro, con isótopos 54 Fe, 56 Fe, 57 Fe y 58 Fe, o el aluminio, que tiene un solo isótopo estable: 27 Al.
Isótopos de hidrógeno
En la naturaleza podemos encontrar tres isótopos de hidrógeno que forman una mezcla de elementos. En la práctica, los isótopos 1 H (hidrógeno-1) y 2 H (hidrógeno-2) representan la mayoría, respectivamente, el 99,985 %y el 0,015 %de la presencia total de hidrógeno. El isótopo 3 H (hidrógeno-3) es inestable y representa solo algunas cantidades mínimas. El hidrógeno-1 es el protio más conocido, el hidrógeno-2 (también llamado deuterio) está formado por un protón y un neutrón, mientras que el núcleo del último isótopo (hidrógeno-3, es decir, tritio) contiene un protón y dos neutrones. Por esta razón, la diferencia de masa entre estos isótopos es significativa: el átomo de deuterio es dos veces más pesado que el de protio, mientras que el tritio es incluso tres veces más pesado que el protio. Como sabemos, el hidrógeno en cualquier forma isotópica existe como una molécula diatómica. Resulta que también puede formar moléculas que contienen diferentes isótopos, es decir, HD (protio-deuterio), HT (protio-tritio) y DT (deuterio-tritio). El deuterio es un isótopo no radiactivo de alta estabilidad. A veces se le llama hidrógeno pesado. Si reemplazamos el hidrógeno-1 por deuterio en una molécula de agua (D 2 O), la molécula cambiará sus propiedades: el punto de fusión aumentará alrededor de 1,5 o C y el punto de congelación descenderá hasta 3,81 o C. Su densidad también aumentará en relación con el H 2 O en alrededor de un 0,1%. Por el contrario, el tritio es un isótopo altamente inestable que también es radiactivo. Su núcleo es un lugar de descomposición radiactiva espontánea que produce átomos de helio. Si comparamos las propiedades fisicoquímicas de los isótopos, encontraremos diferencias esenciales, que se muestran en la Tabla 1. Tabla 1. Comparación de parámetros fisicoquímicos básicos de los isótopos de hidrógeno.
| Isótopo | Símbolo | Densidad [g /l] | Punto de fusión [K] | Punto de ebullición [K] |
| protio | H | 0.08233 | 13.83 | 20.27 |
| Deuterio | D | 0.1645 | 18.73 | 23.67 |
| tritio | T | 0.2464 | 20.62 | 25.04 |
isótopos de carbono
El carbono tiene tres isótopos conocidos: 12 C, 13 C y 14 C, cada uno de ellos con las mismas propiedades químicas. El más común es el carbono-12, que representa hasta el 98,89 %de todos los átomos. El isótopo 13C existente en la Tierra representa alrededor del 1,11%, mientras que el átomo 14C se presenta en uno por alrededor del 10 12 . Este último está predispuesto a una descomposición espontánea, lo que provoca la emisión de radiación beta. Entonces el isótopo se transforma en un átomo de nitrógeno. Un isótopo estable es el carbono-13. Debido a su espín distinto de cero, se puede aplicar en resonancia magnética nuclear de 13 NMR.
Aplicación de isótopos
En los detectores de humo utilizamos isótopos inestables, 241 Am o 238 Pu, que se caracterizan por una descomposición lenta combinada con la emisión de radiación. A medida que aparece el humo, la radiación se bloquea y ya no llega al detector, lo que activa la alarma. La radiación de descomposición de algunos elementos es capaz de destruir microorganismos y, por lo tanto, los isótopos, incluido el 60 Co, pueden usarse para conservar alimentos. En el diagnóstico médico, ciertos núcleos se utilizan para detectar cambios en los órganos analizados, por ejemplo, en los riñones o en el corazón. Tal isótopo se combina con una sustancia biológicamente inactiva con un camino conocido en el cuerpo y lo introduce en el sistema de circulación sanguínea. Esto hace posible rastrear el camino de la radiación y observar cómo se acumula en los tejidos y órganos. En el tratamiento de tumores también aplicamos la radioterapia basada en la emisión de radiación por isótopos inestables como el 226 Ra y el 60 Co. El objetivo de dicha terapia es destruir las células tumorales. Uno de los isótopos de carbono, el 14C , se aplica para ensayar la edad de materiales de origen orgánico. Este núcleo inestable se descompone lentamente, y si el organismo muere (que es cuando se detiene la asimilación del carbono), su concentración de carbono-14 se reduce en proporción a los años que pasan. Algunos isótopos, por ejemplo, 239 Pu y 235 U, se utilizan en plantas de energía nuclear. Durante la descomposición de esos núcleos inestables, se produce energía que a su vez puede convertirse en electricidad.
Masa atómica e isótopos
La masa atómica de los elementos presentados en la tabla periódica es en realidad la masa promediada. Cuando lo calculamos, tenemos en cuenta el número (n) y la composición porcentual (x n ) de cada isótopo del elemento en cuestión, según la siguiente fórmula: 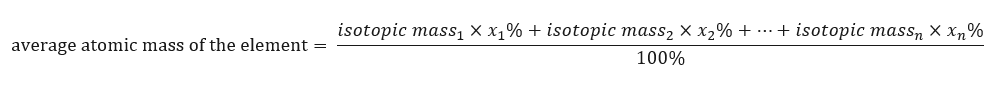 Por ejemplo, al calcular la masa atómica promedio del hidrógeno, obtendremos la siguiente ecuación:
Por ejemplo, al calcular la masa atómica promedio del hidrógeno, obtendremos la siguiente ecuación: 






















































































































