La energía de las reacciones químicas es uno de los elementos importantes que nos permiten comprender las transformaciones que ocurren en una reacción química. Durante dicha transformación, se producen compuestos químicos con una estructura y composición química diferentes a las de las materias primas de las que están hechos. En el curso de una reacción química, los enlaces existentes entre los átomos de las moléculas utilizadas como reactivos se rompen y se producen nuevos enlaces presentes en los productos.

El sistema y el entorno de una reacción química.
Para la interpretación adecuada de una reacción química en términos de energía, necesitamos tener algunos conocimientos sobre lo siguiente:
- Sistema: un área separada de materia con límites claros. El tipo de sistema es importante: es abierto si la reacción implica intercambio de energía y materia, cerrado si la reacción solo implica intercambio de energía, o aislado si no se intercambia energía ni materia.
- Entorno: todo lo que no está incluido en el sistema pero se encuentra cerca.
- Componentes del sistema: todas las sustancias que se encuentran en el sistema analizado y tienen sus propiedades químicas características.
La energía de los enlaces químicos.
El efecto energético que caracteriza a cualquier reacción química es el resultado de los cambios que se producen al romperse y producirse nuevos enlaces entre los átomos. El hecho es que cada ruptura de un enlace químico está intrínsecamente ligada a la absorción de una cantidad adecuada de energía, mientras que la formación de un nuevo enlace provoca la producción de energía. La liberación de energía al medio ambiente puede tener diferentes efectos: calor, luz, trabajo o electricidad. Cada uno de estos procesos es un factor componente que afecta el cambio general en la energía interna del sistema en el que tiene lugar la reacción. Es importante que, independientemente de si los reactivos deben extraer o ceder energía durante la transformación, siempre se requiere una cierta cantidad de energía para iniciar todo el proceso.
La primera ley de la termodinámica.
La primera regla importante acerca de la energía de las reacciones químicas es la relación formulada en la primera ley de la termodinámica, que establece que la energía interna de un sistema que sólo intercambia energía con el medio ambiente (un sistema cerrado) sólo puede transformarse en calor o trabajo. Esto se refleja en la ecuación de Helmholtz: ∆U = Q + W Donde ΔU denota el cambio en la energía interna, Q denota calor y W denota trabajo. Podemos notar a partir de la fórmula que la energía interna de un sistema aislado, es decir, uno que no intercambia energía o masa con el medio ambiente, es constante. Los componentes de la energía interna son todas las energías cinéticas de los átomos, iones, moléculas, electrones y componentes del núcleo atómico, que se encuentran actualmente en el sistema de reacción, así como las energías de sus interacciones, es decir, las energías de los enlaces químicos, interacciones entre cargas, etc. Tenga en cuenta que la energía interna no contiene la energía cinética o potencial del sistema como un todo. La suma de las energías cinética y potencial del sistema como un todo y la energía interna es la energía total del sistema (E).
Entalpía del sistema (H)
Este es otro concepto importante relacionado con la energía de las reacciones químicas, que en la práctica significa la suma de la energía interna del sistema y el producto de su presión y volumen. En términos cualitativos, es la energía requerida para producir un sistema en el vacío (U), incrementada por el trabajo, es decir, el cociente de presión y volumen (pV), que el sistema debe realizar contra fuerzas externas para lograr un volumen diferente de cero. La relación que define la entalpía de un sistema se expresa de la siguiente manera: H = U + pV Una reacción que ocurre en tal sistema provoca un cambio infinitamente pequeño en la entalpía: dH = dU + dpV + pdV Si las condiciones de reacción son isobáricas, entonces si la presión durante el proceso no cambia, la segunda parte se puede omitir, porque dpV=0. Tras sustituir incrementos definidos por diferenciales y tras sustituir la expresión referida al cambio de energía interna del sistema, se obtiene la siguiente relación: ∆H = Q + W + p∆V Suponiendo que el proceso analizado realiza un trabajo volumétrico a presión constante , entonces W = -pΔV, y en consecuencia: ∆H = Q – p∆V + p∆V De la ecuación se deduce que si la reacción ocurre a una presión constante, entonces el cambio en la entalpía del sistema es igual al calor: ∆H = Q
Capacidades energéticas de una reacción.
Con base en la fórmula derivada anteriormente, que indica que el cambio en la entalpía del sistema puede ser igual al calor de la reacción, los procesos se clasifican según las transformaciones térmicas. En términos de la dirección del flujo de energía, dividimos las reacciones químicas en:
- Reacciones exotérmicas, que son aquellas reacciones en las que podemos observar la emisión de energía, por ejemplo en forma de calor, al entorno del sistema. Esto sucede cuando la suma de entalpías de los productos es menor que la suma de entalpías de los sustratos, por lo que cuando ΔH<0.
- Reacciones endotérmicas, es decir, reacciones químicas que provocan la absorción de energía del medio ambiente. Una condición para tal reacción es entregar una cantidad apropiada de esa energía. Esto se aplica a todas las transformaciones en las que la entalpía total de los productos es mayor que la entalpía total de los sustratos, por lo que ΔH>0.
Notaciones de reacciones químicas.
Teniendo en cuenta las reacciones químicas junto con su demanda y distribución de energía, sus efectos de calor específicos se incluyen en la notación de una ecuación química. Para reacciones exotérmicas, el valor absoluto del efecto de calor existente se anota en el lado del producto. Por el contrario, cuando se anota una reacción endotérmica, el valor absoluto de la energía absorbida se anota en el lado del sustrato. Para dar un ejemplo:
- Reacción exotérmica:
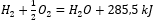
- Reacción endotérmica: 2H 3 PO 4 + 3Mg(OH) 2 + 407kJ = Mg 3 (PO 4 ) 2 + 6H 2 O
Otra forma es anotar una ecuación química junto con el valor del efecto de energía dado a un lado. En este caso, el valor que representa la energía de una reacción exoenergética es negativo, mientras que es positivo para una reacción endoenergética. Por ejemplo:
- Reacción exoenergética: Fe + S → FeS ∆H= -95,2 kJ/mol
- Reacción endoenergética: FeS → Fe + S ∆H= 95,2 kJ/mol
ley de Hess
Constituye una base para los cálculos termoquímicos, afirmando que el efecto del calor es siempre el mismo independientemente de la forma en que se lleve a cabo la reacción. Esto nos permite calcular la entalpía estándar de una reacción (Δ r H ϴ ), asumiendo el uso de condiciones estándar, es decir, una presión de 10 5 Pa y cualquier temperatura. Dado que la entalpía es una función de estado, su variabilidad depende solo de dos valores: en los estados inicial y final, que en una reacción química representan el estado de los sustratos y el estado de los productos, respectivamente. La ley de Hess se expresa mediante una ecuación que contiene coeficientes estequiométricos (v) y entalpías molares estándar de formación (Δ f H ϴ ): 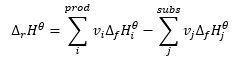
Entalpía molar estándar de formación
Es una entalpía obtenida al formar 1 mol de un compuesto químico particular a partir de elementos en sus estados básicos. El estado básico es la variante más duradera del elemento en condiciones específicas. Para dar un ejemplo, el grafito es la variante más duradera del carbono a 25 o C y 10 5 Pa. Por el contrario, a alta temperatura y presión, una forma estable de carbono es el diamante. Para cada reactivo que participa en una reacción en su condición básica, el valor de la entalpía molar estándar de formación es cero. Por lo general, estos son átomos individuales de gases nobles o las variantes más duraderas de otros gases en condiciones específicas. Para una presión estándar (10 5 Pa) y temperatura (normalmente 25 o C), los valores de las entalpías molares estándar de formación de compuestos se recogen en tablas químicas. La unidad de ese valor es . La ley de Hess aplicada a las reacciones químicas implica que el valor de la entalpía de la reacción es independiente del número de reacciones intermedias. La única información clave es que se utilizan sustratos particulares para obtener productos particulares.
La síntesis de dióxido de carbono.
La síntesis de dióxido de carbono puede llevarse a cabo de varias formas, pero según la ley de Hess cada una de ellas conduce al mismo valor de cambios en las entalpías estándar.
- Síntesis directa
- Síntesis de óxido de carbono (II) + oxidación del compuesto a óxido de carbono (IV)
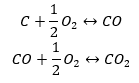 Cuando leemos los valores de las entalpías estándar de formación de los compuestos de la tabla y los sustituimos en las ecuaciones químicas, veremos que la entalpía para cada método es la misma: -393,5 kJ/mol.
Cuando leemos los valores de las entalpías estándar de formación de los compuestos de la tabla y los sustituimos en las ecuaciones químicas, veremos que la entalpía para cada método es la misma: -393,5 kJ/mol.
ley de Kirchhoff
Nos permite transformar los cálculos para calcular la entalpía estándar de una reacción para una temperatura determinada, si conocemos su valor a una temperatura diferente. También conocemos las relaciones entre el calor molar de todos los reactivos y la temperatura. La ley se puede aplicar, ya que el cambio en la entalpía de la reacción depende de las condiciones en las que se determinó: varía junto con el cambio de temperatura y presión. La derivación de la fórmula debe comenzar definiendo la capacidad térmica, que es la relación entre el calor suministrado y el aumento de temperatura: ![]() Asumiendo condiciones isotérmicas, podemos hacer la siguiente transformación:
Asumiendo condiciones isotérmicas, podemos hacer la siguiente transformación: ![]() La integración de la ecuación resultante y la conversión de la capacidad térmica en la parte que representa el cambio en la capacidad térmica estándar se refleja en la ecuación proporcionada por la ley de Kirchhoff:
La integración de la ecuación resultante y la conversión de la capacidad térmica en la parte que representa el cambio en la capacidad térmica estándar se refleja en la ecuación proporcionada por la ley de Kirchhoff: 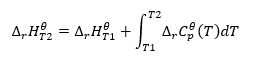 Para condiciones estándar, el cambio en la capacidad térmica de una reacción se define mediante la ecuación con variables v, siendo los factores estequiométricos, y , que representa el calor molar estándar de un reactivo dado. Cuando la diferencia de temperatura es pequeña (hasta 100 K), se supone que el valor del calor molar estándar del reactivo es constante dentro de un cierto rango. Entonces podemos usar la forma simplificada de la ley de Kirchhoff, asumiendo que las capacidades térmicas de los reactivos no dependen de la temperatura sino de la presión constante, :
Para condiciones estándar, el cambio en la capacidad térmica de una reacción se define mediante la ecuación con variables v, siendo los factores estequiométricos, y , que representa el calor molar estándar de un reactivo dado. Cuando la diferencia de temperatura es pequeña (hasta 100 K), se supone que el valor del calor molar estándar del reactivo es constante dentro de un cierto rango. Entonces podemos usar la forma simplificada de la ley de Kirchhoff, asumiendo que las capacidades térmicas de los reactivos no dependen de la temperatura sino de la presión constante, : ![]()
