Es uno de los métodos instrumentales más antiguos utilizados en el análisis químico. Sus cimientos fueron puestos por L. Galvani, CA Volta, JW Gibbs y W. Nernst entre los siglos XVIII y XIX . Las mediciones realizadas con métodos potenciométricos utilizan la fuerza electromotriz (EMF) de una celda construida con dos electrodos sumergidos en la solución probada. El valor de esa fuerza depende directamente de los potenciales de los electrodos utilizados. Estos, a su vez, dependen de la actividad de los iones contenidos en la solución electrolítica y de la naturaleza de los procesos de los electrodos.
Diagrama de procesos de electrodos ejemplificados por la celda de Daniell
La celda de Daniell está formada por dos semiceldas, cada una compuesta por un metal sumergido en la solución de su propia sal. Las semiceldas componentes son los sistemas de Cu (s) /Cu 2+ (aq) y Zn (s) /Zn 2+ (aq) . Cada uno de ellos sufre una de las siguientes reacciones redox:
- reducción
Cu 2+ (ac) + 2e – → Cu (s)
- oxidación
Zn (s) → Zn 2+ (aq) + 2e – Cuando combinamos ambas reacciones, obtenemos la ecuación completa para la reacción que ocurre en la celda: Zn (s) + Cu 2+ (aq) + 2e – → Zn 2 + (aq) + 2e – + Cu (s) Para medir una fuerza electromotriz particular de la celda, tenemos que unir las semiceldas mediante un puente salino y conectar los electrodos a un voltímetro . Así podemos medir la diferencia de potencial entre electrodos individuales, lo que representa el valor EMF de la celda . De acuerdo con la convención de la IUPAC, el diagrama de la celda de Daniell tiene el siguiente aspecto: ϴ Zn|Zn 2+ ||Cu 2+ |Cu ⊕ Las líneas simples representan la interfaz y las líneas dobles representan el puente salino. El potencial en la interfaz es el resultado de las reacciones de oxidación y reducción. Para las celdas, asumimos que el electrodo donde ocurre la oxidación es el ánodo con el signo ϴ, mientras que el otro es un cátodo positivo donde ocurre la reducción . La notación comienza con el ánodo y el cátodo se anota en el lado derecho . La fuerza electromotriz de dicha celda se puede calcular con base en la siguiente fórmula: EMF = potencial de cátodo – potencial de ánodo
Potencial de electrodo estándar
Este término se ha introducido para la sistematización, y un determinado potencial de un electrodo se considera “estándar” si cumple algunas condiciones. La medición debe realizarse a 298 K, la actividad de iones activos debe ser igual a 1 mol/dm 3 y el electrodo de referencia debe ser un electrodo de hidrógeno estándar, ya que se supone que el potencial de ese electrodo es de 0,0000 V.
Fuerza electromotriz de la celda.
El valor de EMF cambia junto con la actividad cambiante de los iones presentes en la celda. La ecuación que refleja esta relación se llama ecuación de Nernst : 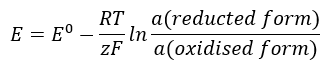 Utiliza los siguientes símbolos: potencial de electrodo (E), potencial de electrodo estándar (E 0 ), constante de gas (R) igual a 8.312 J/K·mol, temperatura (T), el número de electrones involucrados en la reacción electroquímica de electrones (z), constante de Faraday (F) igual a 9,64853·10 4 C/mol, y la actividad de los iones en las formas reducida y oxidada. Para sólidos, se supone que la actividad (a) es 1.
Utiliza los siguientes símbolos: potencial de electrodo (E), potencial de electrodo estándar (E 0 ), constante de gas (R) igual a 8.312 J/K·mol, temperatura (T), el número de electrones involucrados en la reacción electroquímica de electrones (z), constante de Faraday (F) igual a 9,64853·10 4 C/mol, y la actividad de los iones en las formas reducida y oxidada. Para sólidos, se supone que la actividad (a) es 1. 
Instrumentación potenciométrica
El conjunto básico para mediciones potenciométricas consta de dos componentes: un par de electrodos sumergidos en la solución probada y un dispositivo de medición . El primer componente es la celda de medición , mientras que el segundo permite la medición real de su fuerza electromotriz. La parte más importante de una celda son los electrodos. Según su mecanismo de acción, se pueden clasificar en cuatro grupos.
Puente de sal
Un elemento importante de cualquier celda es el puente salino, que permite que el electrodo de referencia entre en contacto con la solución analizada . La característica fundamental de una celda con transferencia es el contacto entre electrolitos de diferentes concentraciones y composiciones. Para evitar la mezcla del electrolito del puente con la solución probada, se utilizan superficies de contacto pequeñas.
Electrodos del primer tipo.
Estos electrodos están hechos de un metal o gas sumergido en la solución que contiene sus propios iones . También se les llama electrodos reversibles al catión , ya que en su superficie ocurre la siguiente reacción reversible: M 0 ↔ M n+ + ne Un ejemplo de electrodos del primer tipo es el electrodo de hidrógeno.
Electrodos del segundo tipo.
Dichos electrodos están construidos de un metal cubierto con su sal escasamente soluble . El sistema se sumerge en una sal libremente soluble, que contiene el mismo anión que la sal escasamente soluble. Estos electrodos se denominan electrodos reversibles al anión común , ya que en su superficie ocurre la siguiente reacción: M 0 + A – ↔ MA + e Ejemplos de electrodos del segundo tipo incluyen los electrodos de plata-cloruro de plata o calomelanos.
Electrodos del tercer tipo.
Estos están compuestos de metales rodeados por dos capas: la primera capa delgada hecha de una sal poco soluble de ese metal, y la segunda capa hecha de una sal un poco mejor soluble que contiene el mismo anión. Son electrodos reversibles a catión común , ya que en su superficie ocurre la siguiente reacción: M 0 (a) + M (b) A ↔ M (a) A + M + (b) + e 
electrodos redox
La estructura de tales electrodos se caracteriza por el uso de un metal químicamente inerte, por ejemplo platino u oro, que se sumerge en una solución que contiene una sustancia tanto en forma reducida como oxidada . Un ejemplo de tales electrodos es el electrodo de quinhidrona.
Funciones de los electrodos en un sistema.
En cuanto a la aplicación en un sistema analítico, distinguimos:
- electrodos de referencia , que mantienen un potencial constante independientemente de las condiciones de medición o la concentración de la solución analizada.
- electrodos indicadores , cuyo potencial cambia si la solución probada contiene iones, a los que son sensibles.
Electrodos de referencia
La medición potenciométrica se basa en la comparación del potencial del electrodo indicador con el electrodo de referencia . Por esta razón, dichos electrodos deben caracterizarse por:
- potencial estable,
- Potencial reproducible e independencia de la temperatura,
- versatilidad y facilidad de uso,
- baja resistencia eléctrica,
- potencial de difusión reproducible y bajo,
- poco flujo del electrolito del electrodo a la solución probada.
Un electrodo de referencia de uso común es el electrodo de plata-cloruro de plata (Ag/AgCl/KCl), que reacciona ante la presencia de iones de cloruro. Está construido con un alambre de plata recubierto con una capa de cloruro de plata. Otro ejemplo es el electrodo de calomelanos (Pt/Hg/Hg 2 Cl 2 /KCl), cuyo potencial también depende de la actividad en una solución de iones de cloruro.
Electrodos indicadores
Para los electrodos de esta categoría , su potencial cambia en presencia de iones probados en la solución . Esto significa que su potencial depende directamente de la actividad, así como de la concentración, de la solución en la que se colocan . Los más utilizados son los electrodos sumergidos en las soluciones de sus propios iones, como los electrodos de plata, mercurio o hidrógeno. Sin embargo, los electrodos de membrana selectivos de iones se utilizan en la potenciometría moderna. Tienen algunas características comunes, por ejemplo, su parte activa es la membrana, y la reacción iónica entre los iones de la solución y la membrana determina la diferencia de potencial en su interfase. Dichos electrodos se pueden dividir según su estructura en electrodos de vidrio, membrana sólida, membrana líquida y membrana doble. Los más utilizados son los electrodos de vidrio, que están construidos con un tubo de vidrio terminado en un bulbo de pared delgada hecho de vidrio de electrodo. Aloja el electrodo interno de plata-cloruro de plata sumergido en la solución interna con una actividad constante de iones.
