La electronegatividad es una cantidad que refleja la tendencia de un átomo determinado dentro de una molécula a atraer electrones hacia sí mismo. En la práctica, es la capacidad de un átomo o grupos funcionales para atraer densidad de electrones. La escala más utilizada asociada a esta cantidad es la introducida por Linus Pauling, que permite calcular fácilmente la naturaleza aproximada del vínculo.

Características de electronegatividad
Las moléculas homonucleares, por ejemplo H 2 y O 2 , tienen coeficientes iguales c A y c B en sus orbitales moleculares, que pueden registrarse como funciones de onda: Ψ +AB = c A Ψ A + c B Ψ B Ψ −AB = c A Ψ A − c B Ψ B En este caso, el orbital se caracteriza por que su forma es simétrica respecto al centro de la molécula, y su carga eléctrica está distribuida igualmente simétricamente en su interior. Sin embargo, otro ejemplo son las moléculas heteronucleares, en las que es prácticamente imposible mantener coeficientes iguales, así como una simetría total con respecto al centro de la molécula. Cuando el nivel de energía del orbital atómico Ψ B es menor que el nivel de energía del orbital atómico Ψ A , se produce la relación y el máximo de la densidad de probabilidad del electrón se desplaza hacia el átomo B. En la práctica, esto da como resultado un desplazamiento del electrón. par en el enlace químico, es decir, polarización hacia el átomo B. Por ejemplo, en la molécula de hidruro de litio LiH este desplazamiento es hacia el átomo de hidrógeno, mientras que en la molécula de fluoruro de hidrógeno HF es hacia el átomo de flúor. Esto significa que el átomo de hidrógeno tiene un nivel de energía más bajo que el del litio, pero un nivel de energía más alto que el del flúor (lea sobre los halógenos ). En estas condiciones, uno de los átomos de ambas moléculas adquiere una carga negativa denotada como -δ y el otro es positiva +δ. La fórmula general de dicha molécula es A +δ B -δ .
Cargas de átomos
La mencionada carga δ puede tomar diferentes valores dependiendo de los elementos unidos por el enlace químico . Su valor de 0 significa que la carga del par de electrones se distribuye simétricamente y el par se ubica completamente en las proximidades del átomo con menor nivel de energía, dando como resultado la transferencia de ambos electrones a ese átomo. Esto crea un enlace iónico entre los elementos. Sin embargo, en la gran mayoría de los enlaces químicos hay cargas fraccionarias, lo que da como resultado un estado entre el enlace covalente y el iónico.
Momento bipolar
Un dipolo es una molécula en la que se pueden distinguir dos polos, positivo y negativo. El momento dipolar, denotado por μ, es una medida de la magnitud del desplazamiento de carga eléctrica en él. Se define como el producto del valor absoluto de la carga eléctrica (δ) contenida en uno de los polos y la distancia a dichos polos (l): μ = δ · l Una carga positiva (δ+) y una carga negativa ( δ-) se llama carga parcial y su ubicación se atribuye a un átomo en particular, pero en realidad es solo la mayor o menor probabilidad de que un electrón esté presente alrededor de su núcleo. Tal fenómeno se confunde en ocasiones con los procesos de oxidación y reducción , pero a diferencia de los cambios que en ellos se producen, dichas cargas al ser asumidas por los átomos no hacen que pasen a otro estado de oxidación, por lo que no existe intercambio de electrones entre ellos. a ellos. La unidad SI para expresar el momento dipolar es el culombio metro (C·m). Sin embargo, en los cálculos la unidad escrita en el sistema CGS, el debye (D), es la más utilizada. Un debye corresponde a un valor de 3,33564·10 -30 C·m. El mayor momento dipolar teóricamente posible caracteriza a las moléculas con un enlace puramente iónico. Mientras que el más pequeño ocurre en moléculas cuyo enlace es puramente covalente: en este caso el momento dipolar es cero. Sin embargo, la mayoría son casos intermedios con caracteres de partículas variables.
Momento dipolar halógeno
Se pueden observar fácilmente varias relaciones entre la electronegatividad y el momento dipolar en compuestos químicos específicos. Tabla 1 Momentos dipolares de haluros de hidrógeno
| Compuesto | Momento dipolar determinado experimentalmente [ μ, D] | Longitud del enlace [pm] | Producto de la carga elemental y la longitud del dipolo [e ·l, D] | Proporción de carácter iónico [ %] | Diferencia en la electronegatividad del halógeno y el hidrógeno. |
| frecuencia cardíaca | 1,98 | 92 | 4.42 | 45 | 1.9 |
| HCl | 1.08 | 128 | 6.15 | 18 | 0,9 |
| HBr | 0,79 | 143 | 6,87 | 12 | 0,7 |
| HOLA | 0,38 | 162 | 7,78 | 5 | 0,4 |
La relación μ/(e·l’), es decir, el momento dipolar real respecto al momento dipolar correspondiente a un enlace iónico, puede proporcionar una medida de las desviaciones del enlace totalmente covalente. El producto de esta relación en forma de (μ/(e·l’))·100%representa el porcentaje del carácter iónico en el enlace. Este es sólo un valor aproximado, ya que el momento dipolar no sólo depende de la polaridad del enlace, sino también del comportamiento de los pares de electrones libres. Sucede que la nube de electrones puede desplazarse hacia el exterior de la molécula, con lo que la ecuación para determinar su momento dipolar tiene un componente adicional. En el caso de la molécula de amoníaco, la nube se dirige en línea con el momento dipolar del enlace, lo que produce un aumento en el momento dipolar resultante. Por el contrario, ocurre lo contrario con la molécula de monóxido de carbono, donde la nube se dirige en la dirección opuesta y, en consecuencia, reduce el momento dipolar resultante. 
Electronegatividad
Es una cantidad empírica adimensional que refleja la tendencia de un átomo determinado dentro de una molécula a atraer electrones hacia sí mismo. En la práctica, es la capacidad de un átomo o grupos funcionales para atraer densidad de electrones. La escala más utilizada asociada a esta cantidad es la introducida por Linus Pauling, que permite calcular fácilmente la naturaleza aproximada del vínculo. El científico utilizó el siguiente método para calcular la electronegatividad de los elementos individuales: Suponemos que D AA y D BB son las energías de enlace de las moléculas de dos átomos (A 2 , B 2 ). Designamos la energía de enlace que se produce en la molécula como D AB . Empíricamente, se ha demostrado que si dicho enlace contiene poco o ningún carácter iónico, la diferencia entre los valores de D AB y la media geométrica de los valores de energía D AA y D BB es igual o cercana a cero. Cuando el enlace AB tiene claras desviaciones del carácter covalente, esta diferencia adquiere valores positivos, que aumentan a medida que aumenta la proporción del carácter iónico. La diferencia entre la electronegatividad (x) de los dos átomos implicados en el enlace se expresa mediante la fórmula: ![]() Por lo tanto, si Pauling asumió una electronegatividad del flúor de 4,0 en sus cálculos, es posible calcular las electronegatividades posteriores de los elementos. Si conocemos el valor x A de los átomos del elemento A y el valor del coeficiente Δ’, entonces podemos calcular el valor x B usando la ecuación anterior. La escala de Pauling está construida de tal manera que sus valores concuerdan aproximadamente con los valores del momento dipolar del enlace formado por los átomos considerados, como podemos ver en el ejemplo de la Tabla 1, que contiene los valores determinados para los haluros de hidrógeno. . Además de la escala descrita anteriormente, existen varias más descritas en la literatura científica, entre ellas la electronegatividad descrita por:
Por lo tanto, si Pauling asumió una electronegatividad del flúor de 4,0 en sus cálculos, es posible calcular las electronegatividades posteriores de los elementos. Si conocemos el valor x A de los átomos del elemento A y el valor del coeficiente Δ’, entonces podemos calcular el valor x B usando la ecuación anterior. La escala de Pauling está construida de tal manera que sus valores concuerdan aproximadamente con los valores del momento dipolar del enlace formado por los átomos considerados, como podemos ver en el ejemplo de la Tabla 1, que contiene los valores determinados para los haluros de hidrógeno. . Además de la escala descrita anteriormente, existen varias más descritas en la literatura científica, entre ellas la electronegatividad descrita por:
- Mulliken, cuyo trabajo asumió que la electronegatividad de un elemento es directamente proporcional a la suma de su afinidad electrónica y su energía de ionización. Afinidad electrónica, que es la cantidad de energía que se libera debido a la unión de un electrón a un átomo neutro, y la energía de ionización igual a la cantidad de energía necesaria para separar un electrón de un átomo neutro. Por lo tanto, las electronegatividades más altas son características de los átomos que exhiben una alta afinidad electrónica y una alta energía de ionización.
- Allred y Rochow, quienes supusieron la proporcionalidad de la electronegatividad a la medida de la fuerza con la que el núcleo atómico (Z) actúa sobre los electrones de valencia, registraron como
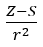 (r – radio atómico, S – constante de cribado). Según su teoría, la electronegatividad (x) de los elementos se puede calcular mediante la fórmula:
(r – radio atómico, S – constante de cribado). Según su teoría, la electronegatividad (x) de los elementos se puede calcular mediante la fórmula:
![]() En cada escala, la electronegatividad del hidrógeno se acerca al valor de 2,2, y los demás valores varían ligeramente. En la Tabla 2 a continuación se muestran ejemplos de electronegatividades de átomos elementales calculadas según las escalas de Pauling, Mulliken y Allred y Rochow. Tabla 2 Electronegatividades de elementos de ejemplo en las escalas de Pauling (P), Mulliken (M) y Allred y Rochow (AR)
En cada escala, la electronegatividad del hidrógeno se acerca al valor de 2,2, y los demás valores varían ligeramente. En la Tabla 2 a continuación se muestran ejemplos de electronegatividades de átomos elementales calculadas según las escalas de Pauling, Mulliken y Allred y Rochow. Tabla 2 Electronegatividades de elementos de ejemplo en las escalas de Pauling (P), Mulliken (M) y Allred y Rochow (AR)
| Átomo | PAG | METRO | Arkansas |
| F | 3,98 | 3.90 | 4.10 |
| oh | 3.44 | 3.04 | 3.50 |
| norte | 3.04 | 2.28 | 3.07 |
| CL | 3.16 | 2,95 | 2.83 |
| C | 2.55 | 1,75 | 2.50 |
| h | 2.20 | 2.21 | 2.20 |
| Si | 1,90 | 2.25 | 1.74 |
| F | 0,82 | 0,77 | 0,91 |
| Rb | 0,82 | 0,50 | 0,89 |
| cs | 0,79 | – | 0,86 |
| fr. | 0,70 | – | 0,86 |
A pesar de las discrepancias en los cálculos con los tres métodos, el flúor tiene la mayor electronegatividad en cada escala, seguido del oxígeno, el nitrógeno y el cloro . Los valores más bajos se determinaron para el francio, el cesio, el rubidio y el potasio. Los elementos que normalmente no son metales tienen electronegatividades superiores al valor de 2, los metales típicos tienen electronegatividades inferiores a 2. El valor estándar es la electronegatividad del hidrógeno antes mencionada de aproximadamente 2,2. 
Electronegatividad en la tabla periódica.
Como muchas otras propiedades, la electronegatividad también se refleja en la disposición de los elementos químicos en la tabla periódica . En el grupo, la electronegatividad disminuye al aumentar el número de capas y el carácter metálico, por lo que aumenta en la dirección del francio al hidrógeno. Con el tiempo, la electronegatividad aumenta con un aumento de los electrones de valencia presentes y una disminución del carácter no metálico, es decir, de metales a gases nobles .
Electronegatividad y tipo de enlace – resumen
Conociendo los valores individuales de la electronegatividad de los elementos que forman el enlace químico podemos deducir su naturaleza. Si la diferencia está entre 0,0 y 0,4, el enlace es covalente. Cuando la diferencia está entre 0,4 y 1,7, el enlace es covalente polarizado. Una diferencia superior a 1,7 en la electronegatividad de los elementos sugiere un enlace iónico.
