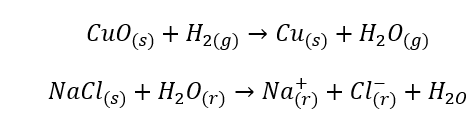Las deliberaciones sobre diversos fenómenos y procesos deben tener múltiples niveles. Debemos tener en cuenta tanto las propiedades microscópicas como las macroscópicas. Como su nombre indica, esta división se realiza separando los órdenes de magnitud de los elementos analizados. El dominio macroscópico, muy ligado a la termodinámica de las reacciones químicas, nos permite observar y medir propiedades físicas y químicas como la densidad, la temperatura o la solubilidad. Por análisis microscópico, podemos observar los movimientos y las interacciones de las moléculas. Podemos describir las moléculas en términos de su velocidad y energía cinética. Si nos interesa una mezcla, podemos tener en cuenta su homogeneidad y, en consecuencia, el tipo de sistema en el que se encuentra.

Clasificación de los sistemas físico-químicos
Al analizar la homogeneidad de los sistemas materiales, la escala macroscópica los clasifica en dos grupos principales: sistemas homogéneos y heterogéneos. Esta categorización se hace por sus características físicas: el estado físico, la solubilidad y el punto de fusión, que pueden diferir o no. Todo sistema incluye todas las sustancias que toman parte en una determinada reacción o proceso. La parte del sistema que se destaca claramente por mantener las mismas propiedades se denomina fase. Hay tres tipos diferentes de fases: sólido, líquido y gas. La superficie situada entre ellos y el resto del sistema se denomina interfaz. Dependiendo de la entalpía libre (ΔG) o de la entropía (ΔS), si ΔS>0 o ΔG<0, la transformación de una fase en otra puede producirse automáticamente.
Diagrama de equilibrio de fase
Una representación gráfica de la existencia de diferentes fases se llama diagrama de equilibrio de fase. Incluye la existencia de fases específicas (si se alcanzan ciertos rangos de temperatura y presión) y sus conversiones mutuas. Un diagrama de equilibrio de fase esquemático para un sistema de un componente ilustra la existencia de tres fases principales dependiendo de las condiciones del proceso. Las líneas que muestra indican los estados de equilibrio entre dos fases respectivas, es decir, entre sólido y gas, entre sólido y líquido, y entre gas y líquido. Así, si conocemos uno de los parámetros críticos, podemos determinar las condiciones que provocarán la fusión, congelación, evaporación, condensación, sublimación o resublimación del ingrediente en cuestión. Además, el diagrama incluye un punto triple donde se conectan todas las líneas de fase, lo que indica que las tres fases pueden coexistir en condiciones específicas. El diagrama también incluye dos puntos importantes: presión crítica y temperatura crítica. La presión crítica está indicada por el punto que representa la presión máxima a la que podemos convertir un líquido en gas, o la presión máxima posible de vapor saturado sobre el líquido. El concepto de temperatura crítica define la temperatura más alta a la que un gas puede condensarse a medida que aumenta la presión. Por lo tanto, el punto crítico existente en condiciones de temperatura crítica y presión crítica define un estado en el que las fases líquida y gaseosa son imposibles de diferenciar.
Regla de la fase de Gibbs
Es una relación específica que se puede aplicar a cualquier sistema existente en equilibrio termodinámico. La ecuación que representa esa regla contiene el número de fases (f) presentes en el sistema con el número de constituyentes independientes (n) y el número de grados de libertad (s). El número s corresponde a la cantidad de variables intensivas ajustables que, si se cambian, no perturbarán el número de fases en el equilibrio del sistema aislado. Las variables intensivas son todos aquellos valores físicos que no dependen en modo alguno del sistema (p. ej., tamaños geométricos o volumen) ni del número de sus moléculas, su peso, calor específico, etc. La ecuación es la siguiente: Los componentes independientes del sistema , designados como n, representan prácticamente el menor número de componentes del sistema necesarios para construir cada una de sus fases en cualquier cantidad. Si analizamos un sistema cuyos componentes pueden reaccionar entre sí, calculamos el valor de n restando el número de ecuaciones de reacción independientes del número total de componentes que forman el sistema. Así, si asumimos la siguiente notación: ![]() el número de ecuaciones independientes es 1: examinamos una reacción particular que ocurre en el sistema. Una ecuación independiente es cualquier sistema de ecuaciones químicas en el que es imposible obtener alguna de ellas combinando las otras. Mientras que el número de componentes para tal sistema es 3: son CaCO 3 , CaO y CO 2 . Esta información también nos permite calcular el número de componentes independientes: n = el número de componentes – el número de ecuaciones independientes, y así: n = 3 – 1 = 2 Podemos usar el mismo ejemplo para calcular el número de grados de libertad usando la ecuación para la regla de fase de Gibbs: s = n – f + 2 = 2 – 3 + 2 = 1 Este valor indica que para mantener una cantidad estable de fases en el equilibrio del sistema, podemos operar solo una variable intensiva.
el número de ecuaciones independientes es 1: examinamos una reacción particular que ocurre en el sistema. Una ecuación independiente es cualquier sistema de ecuaciones químicas en el que es imposible obtener alguna de ellas combinando las otras. Mientras que el número de componentes para tal sistema es 3: son CaCO 3 , CaO y CO 2 . Esta información también nos permite calcular el número de componentes independientes: n = el número de componentes – el número de ecuaciones independientes, y así: n = 3 – 1 = 2 Podemos usar el mismo ejemplo para calcular el número de grados de libertad usando la ecuación para la regla de fase de Gibbs: s = n – f + 2 = 2 – 3 + 2 = 1 Este valor indica que para mantener una cantidad estable de fases en el equilibrio del sistema, podemos operar solo una variable intensiva. 
Sistemas heterogéneos
Cualquier sistema que incluya más de una fase (por lo tanto, un sistema no homogéneo) también es heterogéneo. El tipo de las fases es irrelevante; un sistema heterogéneo puede contener al mismo tiempo varias fases sólidas y líquidas pero solo una fase gaseosa. Esto se debe a que los gases se mezclan perfectamente. Un ejemplo interesante de un sistema heterogéneo es el granito: contiene muchas fases sólidas, que incluyen cuarzo, feldespato de potasio, plagioclasa y biotita. Muchos productos alimenticios también pueden llamarse heterogéneos, ejemplos perfectos son muesli de múltiples ingredientes o salsas para ensaladas que consisten en grasas, especias y otros aditivos. Un tipo interesante de mezclas no homogéneas son los coloides (soluciones cuyos constituyentes solo pueden distinguirse con un microscopio). Sin embargo, en la mayoría de los casos se pueden separar con métodos o herramientas simples. Por ejemplo, para separar una mezcla formada por agua y aceite, podemos usar la decantación: los ingredientes serán visibles a simple vista. Otros métodos que podemos usar para separar de manera efectiva mezclas no homogéneas incluyen: filtración, segregación mecánica o centrifugación. Es similar para una mezcla de minerales que difieren en propiedades: el cuarzo, la mica y el feldespato se pueden separar incluso con un martillo.
Sistemas homogéneos
A diferencia de los sistemas heterogéneos, un sistema homogéneo se caracteriza por la presencia de una sola fase. En tal caso, no podemos distinguir los constituyentes a simple vista. Los métodos simples de separación también son ineficaces, y solo los métodos basados en características físicas pueden resultar útiles. Un ejemplo de tal método es la separación por destilación, que se basa en puntos de ebullición diversificados de un sistema específico. Otros métodos efectivos en la separación de mezclas homogéneas son la cristalización y la cromatografía. Un tipo especial de sistema homogéneo es una sustancia pura cuya única fase contiene un solo componente. Otro ejemplo son todos los tipos de soluciones y mezclas homogéneas: a pesar de la presencia de una sola fase, el sistema puede incluir muchos componentes. Como la fase presente en el sistema puede ser un líquido, un sólido o un gas, las soluciones también pueden adoptar tales formas. Ejemplos de tales sistemas son mezclas líquidas (vinagre, agua), mezclas gaseosas (aire atmosférico) y mezclas sólidas, incluyendo minerales y todo tipo de aleaciones, como bronce o latón.
Transiciones en los sistemas
Dos tipos de transiciones pueden ocurrir en los sistemas, estas son transiciones de fase (a veces llamadas físicas) y químicas. Los primeros incluyen todas las transiciones que no producen nuevas sustancias químicas. Tampoco se caracterizan por la decoloración de los componentes ya presentes. Sin embargo, como su nombre lo indica, conducen a dichos cambios en la estructura o el estado físico. También es posible que se forme una nueva fase mientras que la fase original se desvanece. Los ejemplos de transiciones de fase incluyen resublimación y transiciones polimórficas de elementos. Las transiciones químicas muestran un mecanismo completamente diferente. Estas son reacciones que producen nuevas sustancias que reemplazan a los constituyentes originales. Tales transiciones pueden realizarse en dos variantes, por ejemplo durante la hidrólisis en una o varias fases así como durante la combustión.
Reacciones químicas
- Las reacciones homogéneas ocurren cuando todo el sistema, incluidos los sustratos y los productos, se encuentra en una fase, por ejemplo:
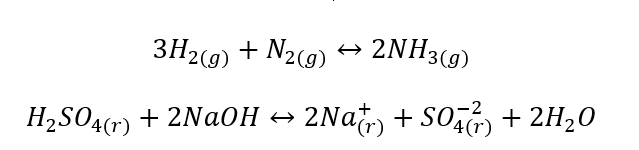
- Las reacciones heterogéneas son reacciones en las que el sistema, incluidos los sustratos y los productos, se encuentra al menos en dos fases diferentes. Tales reacciones siempre ocurren en la interfaz, por ejemplo: