El término "tampones de pH" se refiere a aquellas soluciones acuosas que no cambian su valor de pH a pesar de introducir una pequeña cantidad de bases o ácidos, o durante la dilución. En términos prácticos, son mezclas de soluciones de ácidos débiles y sus sales con bases fuertes concentradas (donador de protones-aceptor de protones) o, análogamente, mezclas de soluciones de bases débiles y sus sales con ácidos fuertes. El objetivo principal del uso de soluciones tampón es que actúen como agentes que permitan mantener el valor de pH en un nivel bastante estable. A menudo se utilizan en una amplia gama de aplicaciones químicas, por ejemplo, en la fabricación de colorantes, durante los procesos de fermentación, así como para determinar el valor de pH de los productos alimenticios, cosméticos y farmacéuticos.
La ecuación de Henderson-Hasselbach
La principal dependencia del valor de pH del tampón del pK a o pK b utilizados para el ácido o la base, respectivamente, así como la relación de las concentraciones del ácido y su base conjugada o, análogamente, la base y su ácido conjugado, es definida por la ecuación de Henderson-Hasselbach. Muestra la correlación entre la fuerza del ácido aplicado y el valor del pH. Para una reacción de muestra de un tampón producido con un ácido débil, el procedimiento es el siguiente: HA + H 2 O ↔ H 3 O + + A – Mientras que la correlación entre [A –], que es la concentración molar de la base conjugada [mol ·dm -3], [HA], siendo la concentración molar del ácido no disociado y el pK a – el logaritmo negativo de la constante de disociación de equilibrio del ácido (K a ), expresada con la ecuación de Henderson-Hasselbach para tal reacción, tiene la siguiente forma: 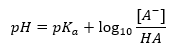
La ecuación de Henderson-Hasselbach para un tampón de acetato
El mecanismo de funcionamiento de los tampones se basa en la presencia de iones, que son capaces de unir iones de hidrógeno o hidróxido. Al considerar un tampón de acetato, que es una mezcla de ácido acético y acetato de sodio, debemos anotar la reacción de disociación entre un ácido acético débil y un electrolito fuerte, acetato de sodio (CH 3 COONa), que se disocia completamente en iones: CH 3 COOH ↔ H + + CH 3 COO – CH 3 COONa → CH 3 COO – + Na + Dado que la solución tampón es una mezcla de estos iones, la adición de una pequeña cantidad de un ácido fuerte introduce [H + } } iones, que se unen inmediatamente a los aniones CH 3 COO – para formar ácido acético que no se disocia en estas condiciones. En consecuencia, esto reduce el valor del pH. De la misma manera, el suministro de cationes OH – adicionales mediante la introducción de una base fuerte en la solución no aumentará el nivel de pH. Se unirán inmediatamente a los iones H + que se originan a partir de la disociación del ácido acético en moléculas de agua no disociadas. La ecuación que define la constante de disociación ácida se presenta a continuación: 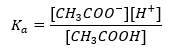 Para la disociación del ácido acético débil, la concentración total del anión CH 3 COO – está definida por la concentración de iones provenientes de la disociación de la sal, que a su vez es igual a la concentración de la sal (c s ), es decir, acetato de sodio. Una alta concentración de estos aniones hace que la concentración de cationes H + disminuya y, en consecuencia, se reduzca el grado de disociación del ácido para mantener estable el valor de Ka. Debido a esta relación, también podemos suponer que el número de moléculas de CH 3 COOH no disociadas es prácticamente idéntico a la concentración total de ácido acético (c k ). Es por esto que la constante de disociación se puede anotar de la siguiente manera:
Para la disociación del ácido acético débil, la concentración total del anión CH 3 COO – está definida por la concentración de iones provenientes de la disociación de la sal, que a su vez es igual a la concentración de la sal (c s ), es decir, acetato de sodio. Una alta concentración de estos aniones hace que la concentración de cationes H + disminuya y, en consecuencia, se reduzca el grado de disociación del ácido para mantener estable el valor de Ka. Debido a esta relación, también podemos suponer que el número de moléculas de CH 3 COOH no disociadas es prácticamente idéntico a la concentración total de ácido acético (c k ). Es por esto que la constante de disociación se puede anotar de la siguiente manera: 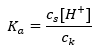 Habiendo tomado el logaritmo, obtenemos una relación que conduce a la ecuación de Henderson-Hasselbach:
Habiendo tomado el logaritmo, obtenemos una relación que conduce a la ecuación de Henderson-Hasselbach: 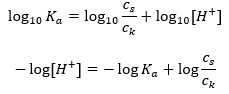 Así, la ecuación de Henderson-Hasselbach tiene la siguiente forma:
Así, la ecuación de Henderson-Hasselbach tiene la siguiente forma: 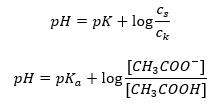 Para escribir las relaciones, el valor de pKa en la ecuación es, de hecho, la medida de la fuerza del ácido. Cualquier valor de pKa inferior a 3 (-log(0,001)) es característico de los ácidos fuertes, mientras que cuanto mayor sea el valor, más débil será el ácido. El hecho que resulta de la ecuación de Henderson-Hasselbach es la equivalencia del valor de pH de la solución tampón y el pK a del ácido en el momento en que la relación entre la concentración del ácido no disociado y la concentración del anión producido por la disociación del ácido es igual a 1, como log(1) es igual a 0. Tales condiciones existen como resultado de la titulación de un ácido débil con una base fuerte, si añadimos una cantidad tal de la base que corresponde a la mitad de la cantidad requerida para la neutralización completa del ácido Entonces el grado de titulación de la solución es del 50%. Debido a la dependencia entre el pH y el volumen del titrante utilizado, el valor del pH en el área del tampón cambia relativamente lentamente.
Para escribir las relaciones, el valor de pKa en la ecuación es, de hecho, la medida de la fuerza del ácido. Cualquier valor de pKa inferior a 3 (-log(0,001)) es característico de los ácidos fuertes, mientras que cuanto mayor sea el valor, más débil será el ácido. El hecho que resulta de la ecuación de Henderson-Hasselbach es la equivalencia del valor de pH de la solución tampón y el pK a del ácido en el momento en que la relación entre la concentración del ácido no disociado y la concentración del anión producido por la disociación del ácido es igual a 1, como log(1) es igual a 0. Tales condiciones existen como resultado de la titulación de un ácido débil con una base fuerte, si añadimos una cantidad tal de la base que corresponde a la mitad de la cantidad requerida para la neutralización completa del ácido Entonces el grado de titulación de la solución es del 50%. Debido a la dependencia entre el pH y el volumen del titrante utilizado, el valor del pH en el área del tampón cambia relativamente lentamente. 
Ejemplo: tampón de amonio
Otro tipo de tampón es el tampón de amonio, que es una mezcla de una base débil (NH 4 OH) con un ácido fuerte (NH 4 Cl). Sin embargo, el mecanismo es muy similar. La sal presente en la mezcla sufre una disociación completa, y su constante es la siguiente ecuación: 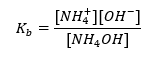 Mientras que la base de amonio prácticamente no se disocia en el electrolito fuerte (NH 4 Cl). Por esta razón, suponemos que la concentración del catión NH 4 + es igual a la concentración de la sal, pero la concentración de moléculas de NH 4 OH no disociadas es idéntica a la concentración de la base. Esto hace posible formular la ecuación y calcular el pH de ese tampón.
Mientras que la base de amonio prácticamente no se disocia en el electrolito fuerte (NH 4 Cl). Por esta razón, suponemos que la concentración del catión NH 4 + es igual a la concentración de la sal, pero la concentración de moléculas de NH 4 OH no disociadas es idéntica a la concentración de la base. Esto hace posible formular la ecuación y calcular el pH de ese tampón. 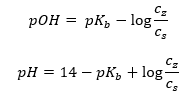 Los iones NH 4 + y Cl – , y las moléculas de NH 4 OH presentes en el tampón de amonio hacen que una vez que añadimos un ácido o una base se produzcan las siguientes reacciones: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Si la adición es pequeña, el cambio en la relación de concentración base-sal y, por lo tanto, el cambio del pH, también es pequeño. En caso de un cambio de diez veces en la relación de estas concentraciones, el valor de pH cambiará en una unidad.
Los iones NH 4 + y Cl – , y las moléculas de NH 4 OH presentes en el tampón de amonio hacen que una vez que añadimos un ácido o una base se produzcan las siguientes reacciones: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Si la adición es pequeña, el cambio en la relación de concentración base-sal y, por lo tanto, el cambio del pH, también es pequeño. En caso de un cambio de diez veces en la relación de estas concentraciones, el valor de pH cambiará en una unidad.
Capacidad del búffer
El término” capacidad amortiguadora” se refiere a la capacidad de una solución amortiguadora para mantener una acidez aproximadamente constante de una solución. Más precisamente, es el número de equivalentes-gramo de un ácido fuerte o de una base fuerte que, cuando se añade a 1 dm 3 de una solución tampón, cambia su valor de pH en uno. La fórmula que define la capacidad amortiguadora (β) incluye su dependencia del número de moles de un ácido/base fuerte después de la adición a la solución amortiguadora (Δn, [ml]) y el cambio en el pH observado al agregar el volumen de un ácido o base fuerte a la solución tampón (ΔpH). ![]() Es un valor que se relaciona fuertemente con las concentraciones de los ingredientes, que aumenta a medida que aumentan. El valor más alto de la capacidad amortiguadora caracteriza las soluciones amortiguadoras cuyo pH es igual a la constante de disociación (pK a ) del ácido utilizado para producirlas.
Es un valor que se relaciona fuertemente con las concentraciones de los ingredientes, que aumenta a medida que aumentan. El valor más alto de la capacidad amortiguadora caracteriza las soluciones amortiguadoras cuyo pH es igual a la constante de disociación (pK a ) del ácido utilizado para producirlas.
Principio de funcionamiento de un tampón de fosfato
Un tipo menos popular de tampones son aquellos que contienen dos sales ácidas. En este caso, son dos sales ácidas del ácido ortofosfórico (V), es decir, fosfato de sodio monobásico (V) y fosfato de sodio dibásico (V). A diferencia de los tampones más comunes, que también se basan en el principio de Brønsted de pares ácido-base conjugados, la naturaleza de los ingredientes no es tan fácil de determinar. Como los aniones presentes en el tampón fosfato muestran valores característicos de los ácidos de Brønsted, deberíamos comprobar con más cuidado la diferencia entre ellos. De acuerdo con ese principio, el ion que es el ácido más fuerte debe tener una constante de disociación más alta.
- Para H 2 PO 4 – K a = 6.34·10 -8
- Para HPO 4 -2 Ka = 4.36·10 -13
Si disponemos de tales datos, podemos afirmar fácilmente que en este caso es el anión de hidrógeno H 2 PO 4 -13 el que es el ácido débil de Brønsted. El mecanismo de funcionamiento del amortiguador se basa en un equilibrio dinámico que se puede expresar mediante la siguiente ecuación: ![]() Si añadimos pequeñas cantidades de ácido a la solución tampón, el sistema intentará evitar los cambios de pH debido a la reacción de bloquear el efecto de los cationes [H +] al protonar el anión hidrógeno, de acuerdo con lo siguiente ecuación:
Si añadimos pequeñas cantidades de ácido a la solución tampón, el sistema intentará evitar los cambios de pH debido a la reacción de bloquear el efecto de los cationes [H +] al protonar el anión hidrógeno, de acuerdo con lo siguiente ecuación: ![]() El hecho de que sea el anión el que neutralice los tampones añadidos a la solución es una consecuencia del hecho de que es ese anión la base de Brønsted más fuerte. En tales sistemas, aplicamos una regla que establece que cuanto más fuerte es el ácido de Brønsted, más débil es su base conjugada. Si añadimos un ácido a un sistema que contiene varias bases de Brønsted, la base más fuerte será la primera en reaccionar. Esta relación es el componente más importante cuando se analizan los equilibrios existentes en mezclas de soluciones tampón acuosas que consisten en una mezcla de ácidos de Brønsted y una mezcla de bases débiles de Brønsted. La misma regla, pero en orden inverso, se aplica cuando agregamos una solución básica en un tampón de fosfato. Los aniones OH – serán capturados casi inmediatamente por el ácido de Brønsted más fuerte presente en el tampón. En este caso, este será el ion, y la reacción se llevará a cabo de acuerdo con la siguiente ecuación:
El hecho de que sea el anión el que neutralice los tampones añadidos a la solución es una consecuencia del hecho de que es ese anión la base de Brønsted más fuerte. En tales sistemas, aplicamos una regla que establece que cuanto más fuerte es el ácido de Brønsted, más débil es su base conjugada. Si añadimos un ácido a un sistema que contiene varias bases de Brønsted, la base más fuerte será la primera en reaccionar. Esta relación es el componente más importante cuando se analizan los equilibrios existentes en mezclas de soluciones tampón acuosas que consisten en una mezcla de ácidos de Brønsted y una mezcla de bases débiles de Brønsted. La misma regla, pero en orden inverso, se aplica cuando agregamos una solución básica en un tampón de fosfato. Los aniones OH – serán capturados casi inmediatamente por el ácido de Brønsted más fuerte presente en el tampón. En este caso, este será el ion, y la reacción se llevará a cabo de acuerdo con la siguiente ecuación: ![]()
Tampones conocidos y sus aplicaciones
- La sangre mantiene los valores de 7,35 y 7,45 unidades, y su estabilidad está garantizada por la presencia de ácido carbónico, principalmente en forma de dióxido de carbono disuelto y HCO 3- Es un tampón siendo un ácido débil y su sal, y cualquier adición de una cantidad excesiva de ácidos o bases provocará condiciones peligrosas para la vida humana. Un ejemplo similar de tampón es la saliva, cuyo pH es de alrededor de 7.
- Tampones de amonio, acetato, fosfato y borato, respectivamente:
- NH 3 + NH 4 Cl pH = 8 – 11;
- CH3COOH + CH3COONa pH 3,5 – 6;
- K2HPO4 + KH2PO4 pH = 5,5 – 8;
- H 3 BO 3 + Na 2 B 4 O 7 pH = 7 – 9.
Todos los tampones populares se aplican donde es crítico mantener el pH a un nivel constante, por ejemplo:
- en medicina, donde se administran por vía intravenosa a pacientes en estado crítico;
- en cultivos microbianos, donde la reacción del suelo es un factor importante;
- en el trabajo con enzimas y proteínas, para estabilizar el medio ambiente para las reacciones químicas;
- en galvanoplastia, donde se utilizan para baños electrolíticos, ya que permiten evitar cambios rápidos y críticos de su pH en la zona cercana al electrodo;
- para calibrar medidores de pH.
