En ce qui concerne leur structure, les acides carboxyliques sont des composés organiques importants et ce sont des dérivés acylés. Ils sont une sorte de matériaux de construction pour de nombreux dérivés, y compris les esters et les amides. Dans la nature, on trouve toute une gamme d'acides carboxyliques divers, comme l'acide acétique CH 3 COOH qui est le composé de base du vinaigre de table, l'acide butyrique CH 3 CH 2 CH 2 COOH responsable de l'odeur de beurre rance, ou plus l'acide cholique complexe, qui est le composant de base des sucs biliaires humains.

La formule générale des acides carboxyliques est :
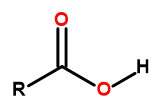
Figure1 La formule générale des acides carboxyliques est :
Nomenclature des acides carboxyliques
Selon le système de nomenclature IUPAC, les acides carboxyliques peuvent être nommés de deux manières, en fonction de la taille et de la complexité de la molécule. Les acides qui sont des dérivés aliphatiques sont nommés systématiquement en changeant la terminaison alcane de -ane en -oique et en ajoutant le mot initial « acide », par exemple, acide propanoïque, acide butanoïque, acide 3-éthyl-6-méthyloctanedioïque. La numérotation des atomes de carbone dans ces composés chimiques commence toujours par l’atome du groupe fonctionnel -COOH. Le deuxième système de dénomination, particulièrement utile pour les acides dans lesquels le groupe carboxyle est attaché au cycle, est autorisé à ajouter les mots "acide" avant et "carboxylique" après au nom systématique du composé. Dans de tels cas, la numérotation des atomes de carbone commence par l’atome auquel le groupe carboxyle est attaché, qui est lui-même traité comme un substituant.
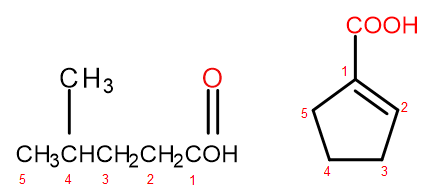
Figure 2 Numérotation des atomes de carbone dans, de gauche à droite : acide 4-méthylpentanoïque, acide 1-cyclopentènecarboxylique.
| Acide carboxylique | Groupe acyle | ||
| La structure | Nom | La structure | Nom |
| HCOOH | Formique | HCO- | Formyle- |
| CH 3 COOH | Acétique | CH 3 CO- | Acétyl- |
| CH 3 CH 2 CH 2 COOH | butyrique | CH 3 CH 2 CH 2 CO- | butyryle- |
| HOOOCCOOH | Oxalique | -OCCO- | Oxalil- |
| HOOC(CH 2 ) 2 COOH | succinique | -OC(CH 2 ) 2 CO- | succinyl- |
La structure et les propriétés physiques des acides carboxyliques
La similitude du groupe carboxyle avec les cétones et les alcools peut suggérer des propriétés physiques similaires. Comme dans les cétones, l’atome de carbone du groupe fonctionnel a une hybridation sp 2 . Ceci est directement lié à sa structure plate et aux angles d’environ 120 ° entre les liaisons CCO et OCO. Par exemple, l’acide acétique CH 3 COOH a des angles de liaison égaux à :
- 119° pour CC= O ,
- 119 ° pour CC-OH,
- 122° pour O =C-OH.
Les longueurs de liaison sont les suivantes :
- 52Å pour CC,
- 25Å pour C=O,
- 31Å pour C-OH.
Les acides carboxyliques montrent leur similitude avec les alcools en raison de leur forte associativité causée par la possibilité de former des liaisons hydrogène. En pratique, la plupart de ces composés existent sous forme de dimères cycliques dont la structure est maintenue par la formation de liaisons hydrogène. Un tel système spécifique de liaisons hydrogène affecte également les points d’ébullition des acides carboxyliques. Il provoque leur augmentation significative par rapport aux alcools correspondants. Par exemple, les constantes physiques – le point de fusion et le point d’ébullition en degrés Celsius sont respectivement :
- Acide formique : 8,4 ; 100,7,
- Acide acétique : 16,6 ; 117.9,
- Acide propanoïque : -20,8 ; 141,
- Acide benzoïque : 122,1 ; 249.
Dissociation des acides carboxyliques
Les propriétés acides de ce groupe de composés leur permettent de réagir avec des bases, dont l’hydroxyde de sodium et le bicarbonate de potassium. Les produits de telles réactions sont des sels d’acides carboxyliques. La solubilité des acides carboxyliques dans l’eau est négligeable, mais leurs sels avec les métaux alcalins, en raison de leur structure ionique, se dissolvent très bien dans l’eau. Ces composés, qui sont des acides dans la théorie de Bronsted-Lowry, se dissocient dans des solutions aqueuses diluées. À la suite de la transformation, l’anion carboxylate RCOO – et le cation hydronium H 3 O + sont formés.
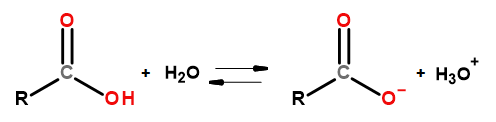
Figure 3Schéma de dissociation de l’acide carboxylique.
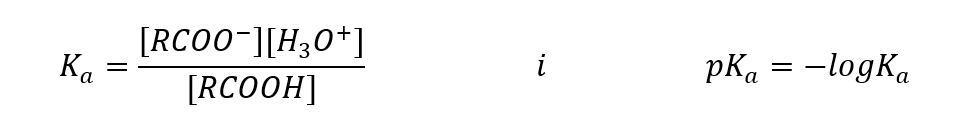 Les valeurs déterminées empiriquement pour les acides carboxyliques montrent qu’il s’agit de composés faiblement dissociés, donc en pratique ce sont aussi des acides faibles. Pour la plupart d’entre eux, la constante K a prend une valeur d’environ 10 -5 . Pour l’acide acétique K a = 1,76.10 -5 , ce qui, après conversion, donne au pK une valeur égale à 4,75. Cela équivaut à la dissociation d’environ 0,1 %seulement des molécules, ce qui, par rapport aux acides inorganiques forts avec un degré de dissociation de 100%, confirme qu’il s’agit d’acides de faible force. Par rapport aux alcools, dont les constantes d’équilibre oscillent dans l’ordre de grandeur 10 -16 , les acides carboxyliques sont beaucoup plus forts. Malgré leur similitude structurelle, ce fait est dû à la stabilité de l’anion carboxylate par rapport à l’anion alcoxyde. Notez que la charge négative dans les alcoxydes est sur un seul atome d’oxygène, qui est hautement électronégatif. En revanche, dans les anions carboxylates, la charge est délocalisée entre les deux oxygènes du groupe fonctionnel. Cela le rend plus stable par rapport à l’anion produit par les alcools.
Les valeurs déterminées empiriquement pour les acides carboxyliques montrent qu’il s’agit de composés faiblement dissociés, donc en pratique ce sont aussi des acides faibles. Pour la plupart d’entre eux, la constante K a prend une valeur d’environ 10 -5 . Pour l’acide acétique K a = 1,76.10 -5 , ce qui, après conversion, donne au pK une valeur égale à 4,75. Cela équivaut à la dissociation d’environ 0,1 %seulement des molécules, ce qui, par rapport aux acides inorganiques forts avec un degré de dissociation de 100%, confirme qu’il s’agit d’acides de faible force. Par rapport aux alcools, dont les constantes d’équilibre oscillent dans l’ordre de grandeur 10 -16 , les acides carboxyliques sont beaucoup plus forts. Malgré leur similitude structurelle, ce fait est dû à la stabilité de l’anion carboxylate par rapport à l’anion alcoxyde. Notez que la charge négative dans les alcoxydes est sur un seul atome d’oxygène, qui est hautement électronégatif. En revanche, dans les anions carboxylates, la charge est délocalisée entre les deux oxygènes du groupe fonctionnel. Cela le rend plus stable par rapport à l’anion produit par les alcools.
Obtention d’acides carboxyliques
- Oxydation d’alkylbenzènes substitués avec KMnO 4 ou Na 2 Cr 2 O 7 avec le produit sous forme d’acides benzoïques substitués. Il est possible d’oxyder des groupes alkyles primaires et secondaires,
- Oxydation de la liaison C=C des alcènes avec au moins un atome d’hydrogène vinylique à l’aide de KMnO 4 ,
- Oxydation des alcools primaires et des aldéhydes. Alcools utilisant le réactif de Jones, aldéhydes utilisant le même réactif et oxyde d’argent basique,
- Hydrolyse des nitriles sous l’influence de solutions fortes et chaudes d’acides ou de bases,
- La réaction des composés de Grignard avec le dioxyde de carbone, avec un produit intermédiaire sous forme de carboxylate de magnésium. Le composé de transition réagit alors avec l’acide.
Réactions des acides carboxyliques
En raison de leur structure, les acides carboxyliques, en plus de leurs réactions caractéristiques, subissent également des transformations similaires aux alcools et aux cétones. Comme les alcools, ils peuvent dissocier un proton pour former un réactif nucléophile. Comme les cétones, ils sont sujets aux attaques d’autres nucléophiles sur l’atome de carbone du groupe carbonyle. De plus, leur réduction, substitution en position alpha, substitution nucléophile du groupe acyle et déprotonation (dissociation) sont possibles. La réduction des acides carboxyliques a lieu avec LiAlH 4 , donnant le produit sous la forme d’un alcool primaire. Parfois, il est nécessaire d’appliquer un chauffage dans une solution de tétrahydrofurane pour augmenter l’efficacité. Une autre méthode est une réduction à l’aide de borane en solution de tétrahydrofuranne, obtenant également 1 o des alcools.
