Par définition, l’activité chimique est la capacité d’un élément à donner des électrons lors de réactions chimiques. En pratique, leur activité augmente avec la diminution de l’électronégativité – une mesure de la capacité d’un élément à attirer les électrons. Si un métal n’attire pas fortement les électrons, il est plus réactif. Un élément de référence, l'hydrogène, est utilisé pour classer l'activité chimique des métaux. Une mesure de l'activité d'un métal est sa capacité à déplacer l'hydrogène des acides ou l'hydrogène d'une molécule d'eau.

Série d’activité chimique des métaux
Ce terme est utilisé pour décrire le résumé des éléments chimiques de nature métallique , dans un ordre spécifique du moins au plus chimiquement actif. Ceci est utilisé pour comparer l’activité de différents métaux. En plus des métaux, la série d’activités chimiques comprend également un non-métal, l’hydrogène , qui est l’élément de référence. Plus un métal se situe haut dans la série d’activités, plus il est réactif . Cela est également lié au fait qu’il s’oxyde plus facilement et constitue donc un réducteur plus puissant et un élément chimiquement plus actif. En revanche, plus un métal est placé bas dans la série d’activités, moins il est réactif. Cela signifie qu’il subit plus facilement une réaction de réduction et est donc un oxydant plus fort, un élément moins actif. En utilisant les valeurs indiquées dans le tableau 1, nous pouvons voir que plus la valeur du potentiel standard d’un élément est faible, plus le réducteur est fort et plus le métal est chimiquement réactif. Une mesure de la capacité à donner des électrons dans une gamme d’activités métalliques est leur valeur potentielle standard . Pour l’hydrogène, ou plutôt l’électrode à hydrogène, le potentiel standard est supposé nul. Le potentiel étalon est la force électromotrice d’une cellule constituée d’une demi-pile étalon à hydrogène et de l’autre demi-pile dans laquelle les concentrations en substrats et produits sont de 1 mol/dm 3 .
| Électrode | Potentiel standard [V] |
| Li/Li + | -3.04 |
| Ca/Ca 2+ | -2,86 |
| Mg/Mg 3+ | -2,36 |
| Al/Al 3+ | -1,69 |
| Mn/Mn 2+ | -1,18 |
| Zn/Zn2 + | -0,76 |
| Cr/Cr 3+ | -0,74 |
| Fe/Fe 2+ | -0,44 |
| CD/CD 2+ | -0,40 |
| Co/Co 2+ | -0,28 |
| Ni/Ni2 + | -0,26 |
| Sn/Sn2 + | -0,14 |
| Pb/Pb 2+ | -0,14 |
| Fe/Fe 3+ | 0,04 |
| H 2 /2H + | 0,00 |
| Bi/Bi 3+ | +0,32 |
| Cu/Cu 2+ | +0,34 |
| Ag/Ag + | +0,80 |
| Hg/Hg 2+ | +0,85 |
| Au/Au 3+ | +1,52 |
Tableau 1 . Série électrochimique des métaux Les métaux visibles en haut de la série sont les plus actifs. Ceux au-dessus de l’hydrogène ont tendance à s’oxyder facilement et sont donc des agents réducteurs plus puissants que l’hydrogène. Les éléments inférieurs à l’hydrogène dans la série sont plus facilement réduits et sont des oxydants plus puissants. Si un métal a un potentiel plus négatif qu’un autre, cela signifie qu’il le déplacera de son sel. Par exemple, le fer déplacera le cuivre dans les sels de cuivre, mais le cuivre ne déplacera pas le fer dans ses sels. Au lieu de cela, il peut déplacer l’argent des sels d’argent. Le lithium et le béryllium provenant de solutions de sels d’autres métaux ne les déplacent pas, mais réagissent directement avec l’eau. Ils déplacent l’hydrogène et produisent leurs composés – les hydroxydes . Ces métaux sont appelés métaux actifs. Activité des métaux et tableau périodique des éléments Comme beaucoup d’autres propriétés, l’activité chimique d’un élément peut être déduite de sa position dans le tableau périodique . Les métaux les plus actifs sont ceux des groupes I et II, car ils déplacent facilement l’hydrogène de l’eau pour former des hydroxydes. Dans le groupe, l’activité chimique des métaux augmente avec l’augmentation du numéro atomique . La période diminue à mesure que le numéro atomique augmente. 
Métaux précieux et communs
L’hydrogène fournit non seulement un point de référence pour l’activité, mais sépare également les métaux précieux et communs dans la série . Les métaux communs sont ceux au-dessus de l’hydrogène. Chacun réagit avec les acides, en chassant l’hydrogène. Du potassium au calcium, ils réagissent avec l’eau déjà à température ambiante, et du magnésium au fer, ils réagissent avec elle à des températures élevées. Tous les métaux qui se trouvent en dessous de l’hydrogène dans la série d’activités ne déplacent pas l’hydrogène des acides . Cependant, ils peuvent réagir avec des acides oxydants pour former les sels et oxydes correspondants, qui sont formés par réduction du résidu acide. Les éléments du bas de la série, de l’argent à l’or, sont si résistants aux réactions chimiques qu’ils ne réagissent qu’avec l’eau régale . Une telle solution est un mélange d’une solution concentrée d’ acide chlorhydrique et d’une solution concentrée d’ acide nitrique (V) , mélangées dans un rapport volumique de 3:1. Connaissant ces faits, nous pouvons déduire que plusieurs réactions peuvent être réalisées pour distinguer l’activité de l’élément : avec de l’eau à température ambiante, avec de l’eau chaude, avec de l’acide non oxydant, avec de l’acide oxydant et avec de l’eau régale.
Expérience pour détecter les métaux déplaçant l’hydrogène des acides
Le moyen le plus simple de confirmer l’activité des métaux est de réaliser une expérience. Pour ce faire, il faudra préparer dix éprouvettes dans lesquelles seront placés successivement : en 1-5 : ruban de magnésium, fil de zinc, fil de fer, fil de nickel et fil de cuivre. Le même ordre doit être répété dans les tubes 6 à 10. Ajoutez quelques millilitres d’acide chlorhydrique dans les tubes 1 à 5 et quelques millilitres d’ acide sulfurique dilué (VI) dans les tubes 6 à 10. Appliquez une attelle de brûlure sur chaque tube. Dans des tubes à essai contenant des rubans de magnésium et des fils de fer, de zinc et de nickel, inondés d’acides, des bulles de gaz sont émises. La libération la plus intense peut être observée dans les tubes contenant du magnésium. Les réactions qui ont lieu sont les suivantes : 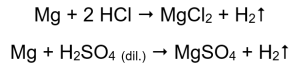 La quantité de gaz émise diminue en série : zinc, fer, nickel. Les réactions suivantes ont lieu en conséquence :
La quantité de gaz émise diminue en série : zinc, fer, nickel. Les réactions suivantes ont lieu en conséquence :  Dans les tubes qui contenaient des fils de cuivre, aucun gaz n’est visible, aucun changement. Cela signifie que de telles réactions ne se produisent pas :
Dans les tubes qui contenaient des fils de cuivre, aucun gaz n’est visible, aucun changement. Cela signifie que de telles réactions ne se produisent pas : 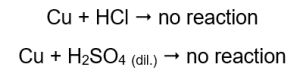 Lorsqu’une attelle brûlante est appliquée, un son distinctif se fait entendre dans les tubes à partir desquels le gaz est émis.
Lorsqu’une attelle brûlante est appliquée, un son distinctif se fait entendre dans les tubes à partir desquels le gaz est émis.
Résumé des observations et conclusions :
Le magnésium, le zinc, le fer et le nickel réagissent à la fois avec l’acide chlorhydrique et l’acide sulfurique (VI). Chacun déplace l’hydrogène de l’acide, ce qui signifie qu’ils se situent plus haut dans la série d’activités métalliques que l’acide. Les réactions produisent des produits sous forme de sels et d’un gaz, l’hydrogène, qui est libéré. Le son distinctif qui accompagnait l’application d’une attelle rougeoyante sur un tube à essai contenant du gaz s’échappant est provoqué par la réaction de l’hydrogène avec l’oxygène. De tous les métaux testés, le magnésium est le plus réactif, suivi du zinc, du fer, du nickel et du cuivre. Nous pouvons le savoir car l’intensité des bulles de gaz indique l’activité du métal. Aucun changement n’a été observé dans les tubes contenant du cuivre. Cela montre que le cuivre est incapable de déplacer l’hydrogène de l’acide chlorhydrique ou de l’acide sulfurique (VI) dilué.
