En termes de structure chimique, les alcanes appartiennent au groupe des hydrocarbures. Ces composés ne contiennent que deux types d'atomes : le carbone et l'hydrogène. Ils sont composés de la charpente carbonée de base liée à des atomes d'hydrogène. Les alcanes n'ont que des liaisons simples, c'est pourquoi ils sont appelés hydrocarbures saturés.

Série homologue
Arrangés par la quantité croissante d’atomes d’hydrogène dans leur structure, les représentants d’alcanes forment une série homologue. Il commence par le méthane, contenant un atome de carbone, et se termine par le décane à neuf atomes de carbone. Les noms des alcanes proviennent de la quantité d’atomes de carbone qui existent dans la structure et sont définis par des chiffres grecs ou latins ainsi que par la terminaison caractéristique -ane, comme pour l’heptane, le nonane, etc. La formule générale des alcanes est la suivante : , où ‘n’ représente le nombre de carbone (C) présent dans la chaîne et ‘H’ représente les atomes d’hydrogène.
| Le nombre d’atomes de carbone présents dans la chaîne | Formule alcane | Nom de l’alcane |
| 1 | CH 4 | Méthane |
| 2 | C 2 H 6 | Éthane |
| 3 | C 3 H 8 | Propane |
| 4 | C 4 H 10 | Butane |
| 5 | C 5 H 12 | Pentane |
| 6 | C 6 H 14 | Hexane |
| sept | C 7 H 16 | Heptane |
| 8 | C 8 H 18 | Octane |
| 9 | C 9 H 20 | Nonane |
| dix | C 10 H 22 | Décane |
Types d’hydrocarbures saturés
En termes de structure de chaîne, on distingue les types d’alcanes suivants :
-
Alcanes linéaires (paraffiniques)
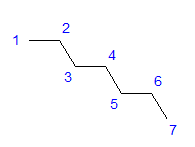 Fig. 1 Formule structurale de l’heptane Tous les atomes de carbone présentent l’hybridation sp 3 . En raison d’un angle tétragonal entre les liaisons, un arrangement en forme de zigzag d’atomes de carbone est nécessaire. Les molécules peuvent prendre diverses dispositions, car une rotation libre est possible autour d’une simple liaison entre les atomes de carbone. Plus le nombre de carbones dans la structure est élevé, plus les formes de chaîne peuvent être variées.
Fig. 1 Formule structurale de l’heptane Tous les atomes de carbone présentent l’hybridation sp 3 . En raison d’un angle tétragonal entre les liaisons, un arrangement en forme de zigzag d’atomes de carbone est nécessaire. Les molécules peuvent prendre diverses dispositions, car une rotation libre est possible autour d’une simple liaison entre les atomes de carbone. Plus le nombre de carbones dans la structure est élevé, plus les formes de chaîne peuvent être variées.
-
Isoalcanes : hydrocarbures saturés ramifiés
La formation d’hydrocarbures ramifiés est l’effet de liaison entre un atome de carbone et plus de deux autres atomes de carbone. Une branche se forme au point d’un tel lien. Les hydrocarbures ramifiés sont des isomères d’hydrocarbures linéaires. 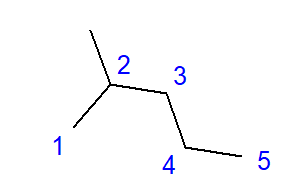 Fig. 2 Formule structurale du 2-méthylpentane La formule du 2-méthylpentane illustrée à la Fig. 2 a un total de six atomes de carbone et est un isomère de l’hexane. Le nom « 2-méthylpentane » signifie que la chaîne pentane a un groupe méthyle lié à la position du deuxième atome de carbone. Le nombre d’isomères structuraux possibles augmente avec le nombre croissant de carbone. Pour donner un exemple, l’hexane peut avoir une structure de 5 isomères différents, l’octane a 18 possibilités de ce type et l’hexane jusqu’à 75.
Fig. 2 Formule structurale du 2-méthylpentane La formule du 2-méthylpentane illustrée à la Fig. 2 a un total de six atomes de carbone et est un isomère de l’hexane. Le nom « 2-méthylpentane » signifie que la chaîne pentane a un groupe méthyle lié à la position du deuxième atome de carbone. Le nombre d’isomères structuraux possibles augmente avec le nombre croissant de carbone. Pour donner un exemple, l’hexane peut avoir une structure de 5 isomères différents, l’octane a 18 possibilités de ce type et l’hexane jusqu’à 75.
-
Hydrocarbures cycliques : cycloalcanes, hydrocarbures alicycliques
Il est possible de fermer la structure de la chaîne tout en formant des anneaux composés d’éléments répétés –CH 2 -. Les noms sont basés sur le nom de l’alcane avec le préfixe « cyclo- », comme le cyclobutane ou le cycloheptane. Pour plus de facilité, ils peuvent être présentés sous forme de polygones réguliers. 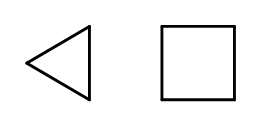 Fig. 3 De gauche à droite : cyclopropane, cyclobutane Il existe également des cycles de substitution, dont les noms incluent les substituants. Dans ce cas, les nombres d’atomes de carbone sont conçus de manière à ce que la localisation des substituants soit éventuellement faible.
Fig. 3 De gauche à droite : cyclopropane, cyclobutane Il existe également des cycles de substitution, dont les noms incluent les substituants. Dans ce cas, les nombres d’atomes de carbone sont conçus de manière à ce que la localisation des substituants soit éventuellement faible.
Représentants les plus importants
Le méthane est un composé de formule moléculaire CH 4 , commençant la série homologue des alcanes. Le carbone est tétravalent, il a donc quatre liaisons CH. A température ambiante, c’est un gaz inodore et incolore. Comme l’atome de carbone présente l’hybridation sp 3 , il est structuré en tétraèdre et les orbitales produites forment des liaisons équivalentes avec quatre atomes d’hydrogène. L’éthane est le prochain alcane de la série, dont la formule moléculaire est C 2 H 6 . En regardant la formule semi-structurale H 3 C-CH 3 , on remarquera que chaque atome de carbone est lié à trois atomes d’hydrogène. Tout comme le méthane et d’autres hydrocarbures inférieurs, c’est un gaz incolore et inodore. Les liaisons CH sont des liaisons frontales sigma sp-s, tandis qu’une simple liaison entre les atomes de carbone est une liaison frontale sigma sp-sp.
La synthèse des alcanes
- L’hydrogénation des alcènes ou des alcynes

- L’hydrolyse des composés de Grignard
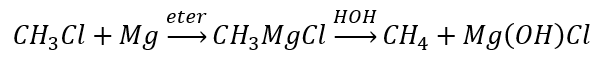
- La réduction des halogénures d’alkyle
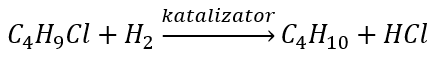
- Réaction de Wurtz
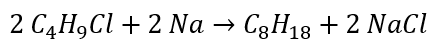
La réduction des aldéhydes et des cétones
- Réduction de Clemmensen
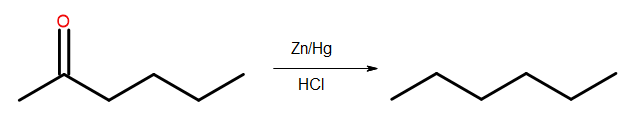 Fig. 4 Schéma de réduction de Clemmensen
Fig. 4 Schéma de réduction de Clemmensen
- Réaction de Wolff-Kishner
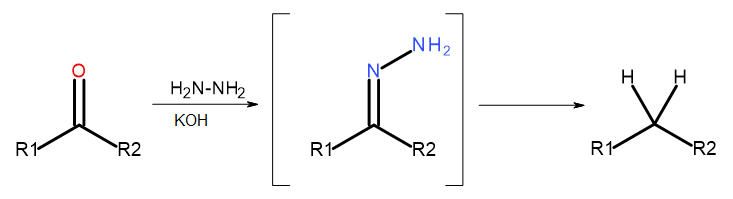 Fig. 5 Diagramme de Wolff-Kishner
Fig. 5 Diagramme de Wolff-Kishner
Les propriétés physico-chimiques des alcanes
Les alcanes à chaîne courte de C 1 à C 4 à température ambiante sont des gaz. D’autres homologues (à partir du pentane) sont des liquides à point d’ébullition croissant. Les ramifications présentes dans la structure entraînent un point d’ébullition inférieur des isomères. La dépendance à l’ajout d’un autre groupe -CH 2 – dans la structure augmente le point d’ébullition d’environ 20 à 30 o C tout en augmentant la longueur de la chaîne carbonée. L’état d’agrégation des alcanes à partir de l’octadécane est solide avec des points de fusion à partir de 28 o C pour le n-octadécane. Les hydrocarbures solides comprennent la paraffine, tandis que les hydrocarbures liquides supérieurs comprennent l’huile de paraffine. En raison de leur nature hydrophobe, les molécules d’alcane ne se mélangent pas à l’eau, ne sont pas mouillées par l’eau et ne se dissolvent pas dans l’eau. Cependant, avec leur affinité pour les caractéristiques non polaires, ils se dissolvent facilement en eux-mêmes et dans des solvants organiques similaires non polaires, moyennement et faiblement polaires. La solubilité des alcanes dans deux solvants alcooliques populaires (méthanol et éthanol) est relativement bonne. Dans le méthanol, les alcanes ne se dissolvent bien que jusqu’à une concentration spécifiée. L’excès de cette concentration provoque la séparation des phases. Dans l’éthanol, les alcanes inférieurs se dissolvent très facilement, alors qu’il est un peu plus difficile de dissoudre les alcanes supérieurs. Les hydrocarbures supérieurs sont des substances inflammables. Les hydrocarbures gazeux ainsi que les couples d’hydrocarbures liquides forment des mélanges potentiellement explosifs lorsqu’ils sont mélangés à l’air. La réactivité des alcanes est relativement faible en raison du manque de groupes fonctionnels potentiellement réactifs. Les liaisons entre les atomes de carbone (CC) ainsi que celles entre les atomes de carbone et d’oxygène (CH) sont très résistantes au clivage. Les énergies de ces liaisons sont respectivement de 88 kcal/mol et 104 kcal/mol. Ils ne peuvent réagir brusquement que dans certaines conditions.
Les réactions des alcanes
- Combustion complète – avec émission de dioxyde de carbone
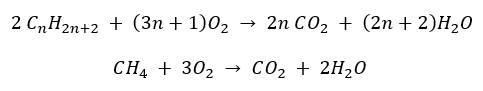
- Semi-combustion – avec une quantité limitée d’oxygène et l’émission de monoxyde de carbone
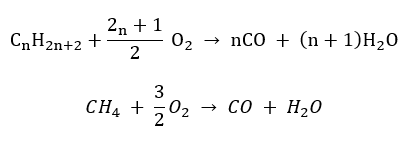
- Combustion incomplète – le noir de carbone se forme avec une quantité très limitée d’oxygène
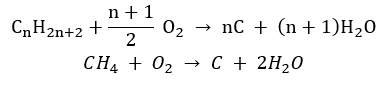
- La réaction de substitution (halogénation radicalaire, illustrée par la réaction du méthane avec le chlore avec la participation de la lumière)
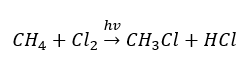
- La pyrolyse est la décomposition des alcanes en molécules plus petites à très haute température. Selon le procédé, un craquage, un hydrocraquage ou une isomérisation peuvent se produire.
- Nitration avec utilisation d’acide nitrique(V) et formation d’un mélange de produits : isomères avec le substituant –NO 2 à divers endroits.
- Sulfonation en deux étapes, où les mersols sont des produits intermédiaires et les mersolans sont le produit final.
























































































































