C'est l'une des deux principales divisions de la chimie analytique, qui traite de la détection d'éléments chimiques, de groupes fonctionnels ou d'ions existant dans la structure testée. En termes de méthodes utilisées, on peut diviser l'analyse chimique en analyse classique et en analyse instrumentale. L'analyse classique repose sur des méthodes basées sur des réactions chimiques qui peuvent être réalisées en mode « sec » ou « humide ». En revanche, l'analyse instrumentale repose sur des instruments, c'est-à-dire des instruments de mesure analytiques dont l'élément principal est le détecteur.

Analyse classique : réactions sèches
Le terme «réactions sèches» fait référence aux changements qui se produisent dans les composés chimiques lorsqu’ils sont soumis à des températures élevées. Nous distinguons trois types principaux de telles réactions :
- faire fondre l’échantillon testé avec des fondants solides,
- obtenir des perles de borax ou de sel microcosmique,
- colorer la flamme du brûleur à gaz.
La plus populaire est la troisième méthode, appelée test de flamme et permettant de détecter de nombreux éléments. Ceci est un exemple d’une technique qui utilise l’émission de rayonnement. Elle consiste à examiner le rayonnement caractéristique émis par les atomes d’éléments particuliers une fois qu’ils sont excités par une température élevée. En effet, il a été démontré que de telles conditions provoquent l’évaporation des composés de certains métaux, et les vapeurs produites sont excitées et colorent de manière caractéristique la flamme du brûleur. La couleur est un effet de l’excitation d’atomes particuliers qui, tout en étant restaurés à leur état d’origine, émettent un quantum de lumière qui se réfère à une longueur d’onde spécifiée. Par exemple, les couleurs de flamme caractéristiques d’éléments particuliers sont les suivantes :
- sodium : jaune intense,
- potassique : violette,
- calcium : rouge brique,
- baryum : vert,
- bismuth : bleu clair.
Analyse classique : réactions humides
Ce sont tous les types de réactions qui se produisent entre les échantillons testés et les solutions de divers réactifs chimiques . Pour effectuer de telles réactions, la substance testée doit être transformée en solution. Les réactions appliquées sont sélectionnées en fonction de nombreux critères, de sorte qu’elles :
- présentent une sensibilité élevée, c’est-à-dire se produisent déjà à de faibles concentrations de la substance détectée ;
- se produisent en peu de temps et montrent des changements facilement observables tels qu’un changement de couleur de la solution, de précipitation ou d’émission de gaz ;
- sont sélectifs, c’est-à-dire n’apparaissent qu’au sein d’un groupe d’ions connu.

Analyse qualitative : chimie inorganique
En chimie inorganique , l’analyse qualitative s’articule autour de deux thèmes : la détection des cations et des anions. La chimie inorganique utilise des réactions caractéristiques qui impliquent des réactifs de groupe appropriés. Ils sont appelés "réactifs de groupe" car les cations ont été divisés en cinq catégories. Un tel réactif forme des sédiments avec un seul d’entre eux, ce qui permet d’affiner les types de cations présents dans l’échantillon selon le schéma suivant :
- Groupe 1 : Ag + , Hg 2 2+ , Pb 2+ – réactif de groupe 3M HCl ;
- Groupe 2 : Hg 2+ , Cu 2+ , Cd 2+ , Bi 3+ , As 3+ , As 5+ , Sb 3+ , Sb 5+ , Sn 2+ , Sn 4+ – réactif de groupe H 2 S dans un environnement HCl 1M ;
- Groupe 3 : Ni 2+ , Co 2+ , Fe 2+ , Fe 3+ , Mn 2+ , Zn 2+ , Al 3+ , Cr 3+ – réactif du groupe (NH 4 ) 2 S dans un environnement tampon d’ammonium ;
- Groupe 4 : Ca 2+ , Sr 2+ , Ba 2+ – réactif du groupe (NH 4 ) 2 CO 3 dans un environnement tampon d’ammonium ;
- Groupe 5 : Mg 2+ , Na + , K + , NH 4 + – aucun réactif de groupe.
Une fois que nous avons exclu certains groupes de cations, nous pouvons poursuivre l’identification en utilisant d’autres réactifs, cette fois ceux qui sont caractéristiques d’ions particuliers. Une telle réaction permet une identification sans ambiguïté. Par exemple, la détection des ions Ag + dans un échantillon se fait en deux temps :
- La réaction avec un réactif de groupe : production d’un sédiment blanc
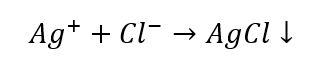
- La réaction caractéristique : dissoudre le sédiment d’AgCl dans une solution aqueuse d’ammoniac, en obtenant un composé complexe incolore.
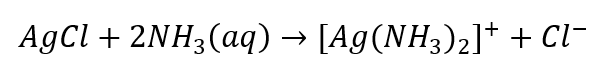
Nous pouvons identifier les anions, qui sont divisés en trois groupes, de la même manière :
- Groupe 1 : BO 2 – , CO 3 2- , C 2 O 4 2- , SiO 3 2- , PO 4 3- , AsO 3 3- , AsO 4 3- , SO 3 2- , S 2 O 3 2- , SO 4 2- , F – , CrO 4 2- , Cr 2 O 7 2- – réactif du groupe BaCl 2 , formation de sels peu solubles dans l’eau;
- Groupe 2: C 4 H 4 O 6 2- , S 2- , Cl – , ClO – , Br – , I – , CN – , SCN – – réactif de groupe AgNO 3 , la formation de sels peu solubles dans l’eau et dilués acide nitrique;
- Groupe 3 : CH 3 COO – , NO 2 – , NO 3 2- , ClO 3 – , ClO 4 – , MnO 4 – – le réactif du groupe contient des cations argent ou baryum ; la formation de sels solubles dans l’eau.
L’identification des cations est un peu plus problématique par rapport aux anions, car la séquence des procédures dépend des résultats des réactions de groupe, et il y a des ions qui perturbent le processus d’identification. Par exemple, pour détecter un ion CO 3 2- , nous devons effectuer les réactions suivantes :
- Les ions Ba 2+ produisent un sédiment blanc soluble dans les acides
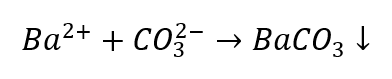
- Les acides dilués provoquent une décomposition avec précipitation de CO 2
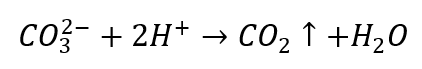
- Le dioxyde de carbone fait bouillonner la solution. Il peut être recouvert d’eau de chaux, car les sédiments blancs précipiteront.
* Ions perturbateurs : SO 3 2- et S 2 O 3 2- forment également des sédiments blancs avec le cation calcium. Ils doivent être oxydés pour éliminer la perturbation. 
Analyse qualitative : chimie organique
L’analyse qualitative des composés organiques comprend plusieurs étapes, et le point clé est de résoudre cinq problèmes fondamentaux :
- Dosage de paramètres physiques tels que le point de fusion ou d’ébullition. Malheureusement, il existe de nombreux composés chimiques avec les mêmes points de température, et la mesure elle-même peut être affectée par une erreur. Cependant, si nous disposons d’un étalon de référence approprié, cette méthode peut nous permettre d’identifier rapidement le composé. De plus, en mesurant les températures, nous pouvons déterminer la pureté du composé, car les plages de température sont étroites. La constance de T top après au moins une cristallisation peut également suggérer une grande pureté du composé. Pour les liquides, cela peut indiquer une plage de distillation étroite.
- Le dosage de la composition élémentaire peut exclure ou confirmer la présence de types particuliers de composés organiques. A titre d’exemple, en excluant la présence d’atomes d’azote dans la structure, on exclut également la présence de groupements amino ou nitriques. Pour cela, nous réalisons des expériences caractéristiques telles que le test de Lassaigne pour l’azote, le test de Beilstein pour les halogènes, ou le test du soufre au nitroprussiate de sodium.
- Tester la solubilité du composé nous permet de le classer dans le groupe des composés aux propriétés chimiques spécifiées. Selon le principe « comme se dissout comme », les composés ont été divisés en 7 catégories.
- L’identification des groupes fonctionnels nécessite des réactions analytiques appropriées qui permettent d’exclure ou d’identifier des groupes fonctionnels.
- L’analyse spectrale est le point le plus fiable permettant d’identifier clairement un composé chimique. Il couvre toutes les techniques instrumentales, telles que :
- La spectrométrie de masse (MS) , qui consiste à ioniser les molécules et à détecter le nombre d’ions en déterminant leur rapport masse sur charge. Cela nous permet de tirer des conclusions sur la masse du composé analysé ;
- Spectroscopie par résonance magnétique nucléaire (RMN) , qui fournit des informations spécifiques sur la structure. Il fournit une image des noyaux magnétiques ( 13 C, 1 H), ce qui permet une interprétation fine de leur qualité ;
- La spectroscopie infrarouge (IR) utilise une gamme étroite de rayonnement électromagnétique pour montrer les types de vibrations existant dans la molécule testée.
