Un mélange homogène d'au moins deux substances est considéré comme une solution. Bien que nous considérions une solution principalement comme un liquide, les mélanges gazeux et solides sont également des solutions. Néanmoins, un très grand nombre de réactions chimiques, tant à l'échelle du laboratoire qu'à l'échelle industrielle, se produit en milieu aqueux. Il existe trois types de solutions liquides - le solvant est toujours liquide, mais le soluté peut être un gaz, un liquide ou un solide. Parmi les exemples figurent des solutions aqueuses de chlorure d'hydrogène, d'éthanol et de sel de cuisine.

Description de la composition de la solution
La caractéristique la plus importante de toute solution est la définition de sa composition. La capacité de déterminer la composition d’une solution et de la recalculer en fonction des unités d’intérêt est une compétence de base de tout chimiste. La quantité d’un ingrédient donné dans un mélange peut être définie de différentes manières, par exemple en masse, en volume ou en molarité. Pour cette raison, il existe également plusieurs types de concentrations, définissant la dépendance de la quantité du composant sur la quantité de la solution ou du mélange. Le plus souvent, pour décrire la composition des solutions, nous utilisons les termes : fraction massique, fraction volumique, fraction molaire et concentration molaire. Les fractions indiquent quelle partie d’un mélange donné l’ingrédient d’intérêt représente. Ils peuvent être exprimés en unités de masse, de volume ou de moles du composé.
concentration molaire
C’est la concentration la plus fréquemment choisie, en raison de la commodité d’utilisation en déterminant le nombre de moles de la substance contenue dans le volume de la solution. La base théorique est l’affirmation selon laquelle des solutions de deux substances différentes de même concentration et volume, à la même température, contiennent le même nombre de moles, et donc le même nombre de molécules du soluté. Sur la base de cette relation, pour des solutions avec des concentrations molaires égales, il est possible de mélanger des volumes appropriés de solutions pour obtenir la proportion correcte du nombre de moles déterminées par les coefficients stoechiométriques. Cela signifie que, si l’on pense aux réactions de type A + B → C, où une mole de substance A réagit avec une mole de substance B, des volumes égaux des deux solutions avec la même concentration molaire doivent être mélangés pour que la réaction se déroule complètement. Dans le cas d’une réaction de type A + 2B → C, c’est-à-dire qu’une mole de substance A réagit avec deux moles de substance B, un volume de solution A doit être mélangé avec deux volumes de solution B. Dans ce cas, il existe également une autre solution, car au lieu d’utiliser des solutions équimolaires dans un rapport volumique de 1:2, on peut utiliser un volume de solution A et un volume de solution B de concentration double. La concentration molaire, notée C m , définit le nombre de moles d’une substance contenue dans une unité de volume, le plus souvent dans 1 dm 3 , d’une solution. La formule permettant le calcul de la concentration molaire est le quotient du nombre de moles de la substance (n s ) et du volume total de la solution (V sol ) en dm 3 : 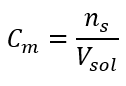 En utilisant l’unité de volume de base selon le système SI, c’est-à-dire le mètre cube, les kilomoles doivent être utilisées comme unité de quantité de la substance. Cependant, ce n’est pas un problème de calcul majeur, car
En utilisant l’unité de volume de base selon le système SI, c’est-à-dire le mètre cube, les kilomoles doivent être utilisées comme unité de quantité de la substance. Cependant, ce n’est pas un problème de calcul majeur, car 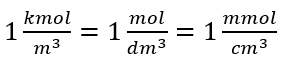 . L’unité de concentration molaire C m est définie en mole par décimètre cube, souvent notée M. 1 mol/dm 3 = 1M
. L’unité de concentration molaire C m est définie en mole par décimètre cube, souvent notée M. 1 mol/dm 3 = 1M 
L’utilisation de la concentration molaire
a) Calcul de la concentration molaire en fonction de la teneur du composant dans la solution Exemple 1. La solution contient 30 g d’hydroxyde de potassium dans 3,0 dm 3 de la solution. Calculer sa concentration molaire. Étape 1. Calcul de la masse molaire de KOH 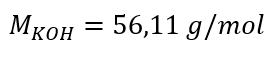 Étape 2. Calcul du nombre de moles de KOH dans la solution
Étape 2. Calcul du nombre de moles de KOH dans la solution 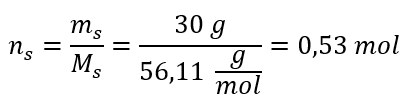 Étape 3. Calcul de la concentration molaire à l’aide de la formule
Étape 3. Calcul de la concentration molaire à l’aide de la formule 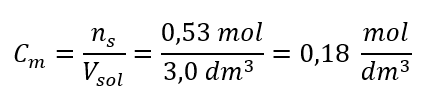 Réponse : La concentration molaire d’une solution d’hydroxyde de potassium contenant 30 g de la substance dans 3,0 dm 3 de la solution est C m =
Réponse : La concentration molaire d’une solution d’hydroxyde de potassium contenant 30 g de la substance dans 3,0 dm 3 de la solution est C m = 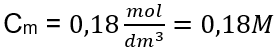 b) Préparation d’une solution de concentration donnée Exemple 2. Calculer la masse de glucose (C 6 H 12 O 6 ) nécessaire à la préparation de 300 cm 3 d’une solution de concentration 0,32 mol/dm 3 . Étape 1. Calcul de la masse molaire de glucose
b) Préparation d’une solution de concentration donnée Exemple 2. Calculer la masse de glucose (C 6 H 12 O 6 ) nécessaire à la préparation de 300 cm 3 d’une solution de concentration 0,32 mol/dm 3 . Étape 1. Calcul de la masse molaire de glucose 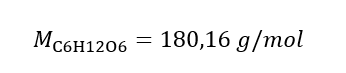 Etape 2. Calcul de la masse de glucose nécessaire, à l’aide de la formule molaire convertie, sachant que
Etape 2. Calcul de la masse de glucose nécessaire, à l’aide de la formule molaire convertie, sachant que 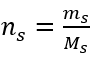 :
: 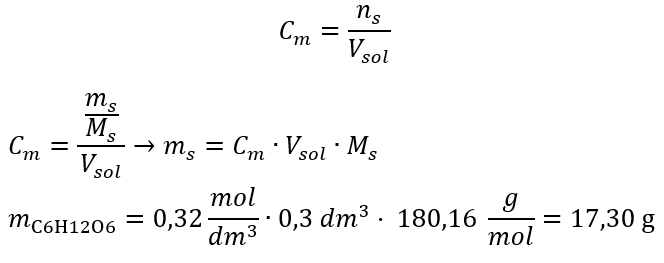 Après ces calculs, on sait que pour préparer une telle solution, il faut peser 17,30 g de glucose et les transvaser quantitativement dans une fiole jaugée de 300 cm 3 . Réponse : Pour préparer 300 cm 3 d’une solution de glucose de concentration molaire 0,32 mol/dm 3 , il faut peser 17,30 g de substance. c) Dilution et concentration des solutions concentrées A partir de la concentration molaire, on peut aussi préparer une solution d’une concentration donnée (C m2 ) en diluant la solution concentrée (C m1 ), où :
Après ces calculs, on sait que pour préparer une telle solution, il faut peser 17,30 g de glucose et les transvaser quantitativement dans une fiole jaugée de 300 cm 3 . Réponse : Pour préparer 300 cm 3 d’une solution de glucose de concentration molaire 0,32 mol/dm 3 , il faut peser 17,30 g de substance. c) Dilution et concentration des solutions concentrées A partir de la concentration molaire, on peut aussi préparer une solution d’une concentration donnée (C m2 ) en diluant la solution concentrée (C m1 ), où : 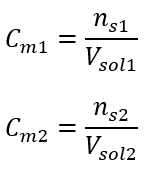 Lors de la dilution, seul le volume de la solution change, le nombre de moles de soluté reste inchangé. Alors on peut supposer que :
Lors de la dilution, seul le volume de la solution change, le nombre de moles de soluté reste inchangé. Alors on peut supposer que : ![]() En transformant la formule de la concentration molaire, on obtient les relations suivantes :
En transformant la formule de la concentration molaire, on obtient les relations suivantes : 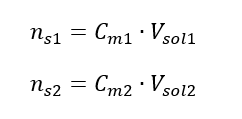 Sachant qu’on obtient l’équation :
Sachant qu’on obtient l’équation : 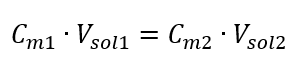 La formule de dilution des solutions, en tenant compte de la concentration molaire, y compris le (C mx ) nouvellement obtenu peut être notée comme suit :
La formule de dilution des solutions, en tenant compte de la concentration molaire, y compris le (C mx ) nouvellement obtenu peut être notée comme suit : 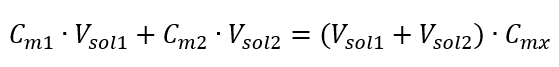 Exemple 3. Quel volume d’acide à 0,150 mol/dm 3 peut-on obtenir en diluant 250 cm 3 d’une solution à 0,750 mol/dm 3 de cet acide avec de l’eau ? Étape 1. Transformation de la formule en supposant que la concentration en eau est C m2 = 0 mol/dm 3 .
Exemple 3. Quel volume d’acide à 0,150 mol/dm 3 peut-on obtenir en diluant 250 cm 3 d’une solution à 0,750 mol/dm 3 de cet acide avec de l’eau ? Étape 1. Transformation de la formule en supposant que la concentration en eau est C m2 = 0 mol/dm 3 . 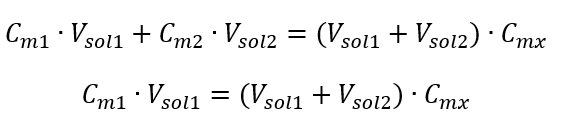 Étape 2. Calcul du volume total (V x )
Étape 2. Calcul du volume total (V x ) 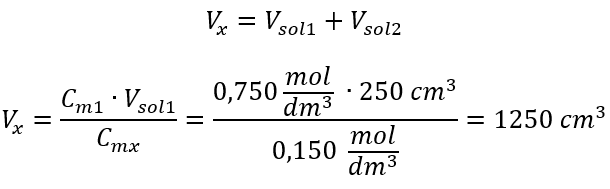 Alternativement, les relations de permanence du nombre de moles lors de la dilution peuvent être utilisées :
Alternativement, les relations de permanence du nombre de moles lors de la dilution peuvent être utilisées : 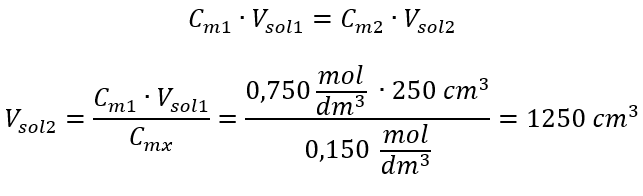 Réponse : Pour diluer l’acide à la concentration requise, il faut utiliser 1,25 dm 3 d’eau. Exemple 4. Calculer la quantité d’eau qu’il faut évaporer de 300 cm 3 d’une solution à une concentration de 0,125 mol/dm 3 pour obtenir une solution à une concentration de 1,50 mol/dm 3 . Étape 1. Transformation de la formule de variation de la concentration molaire en supposant que la concentration molaire de l’eau est C m2 = 0 mol/dm 3 .
Réponse : Pour diluer l’acide à la concentration requise, il faut utiliser 1,25 dm 3 d’eau. Exemple 4. Calculer la quantité d’eau qu’il faut évaporer de 300 cm 3 d’une solution à une concentration de 0,125 mol/dm 3 pour obtenir une solution à une concentration de 1,50 mol/dm 3 . Étape 1. Transformation de la formule de variation de la concentration molaire en supposant que la concentration molaire de l’eau est C m2 = 0 mol/dm 3 . 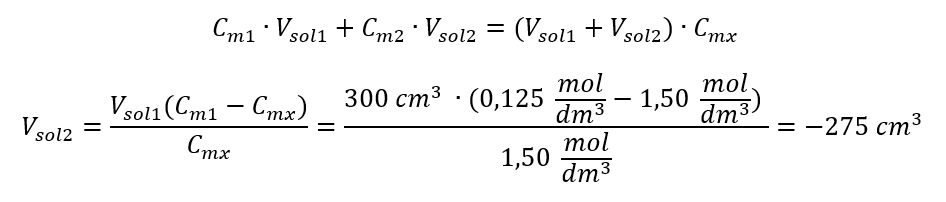 Réponse : Pour concentrer la solution, le 275 doit être évaporé. La conversion de la concentration molaire par rapport à la concentration en pourcentage Dans le travail quotidien de laboratoire, il est nécessaire de convertir différentes concentrations de solutions. Le plus souvent, la concentration molaire et la concentration en pourcentage sont utilisées. Il est possible de basculer entre eux en utilisant la densité de la solution. Ce paramètre doit être introduit dans les formules des concentrations d’intérêt :
Réponse : Pour concentrer la solution, le 275 doit être évaporé. La conversion de la concentration molaire par rapport à la concentration en pourcentage Dans le travail quotidien de laboratoire, il est nécessaire de convertir différentes concentrations de solutions. Le plus souvent, la concentration molaire et la concentration en pourcentage sont utilisées. Il est possible de basculer entre eux en utilisant la densité de la solution. Ce paramètre doit être introduit dans les formules des concentrations d’intérêt : 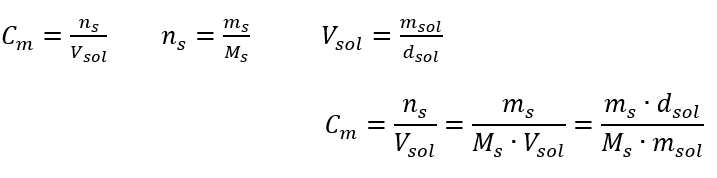 Dans la transformation, nous pouvons voir le rapport de la masse de la substance à la masse de la solution, qui est la base de la concentration en pourcentage, exprimée par la formule :
Dans la transformation, nous pouvons voir le rapport de la masse de la substance à la masse de la solution, qui est la base de la concentration en pourcentage, exprimée par la formule : 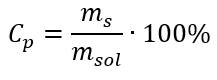 En substituant la formule de la concentration en pourcentage à la formule précédemment transformée de la concentration molaire, nous obtenons une relation qui nous permet de basculer librement entre les deux valeurs :
En substituant la formule de la concentration en pourcentage à la formule précédemment transformée de la concentration molaire, nous obtenons une relation qui nous permet de basculer librement entre les deux valeurs : 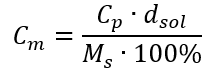 La seule limite de la formule est l’utilisation d’unités appropriées, il vaut donc la peine de les prendre en compte dans tous les calculs. Exemple 5. Calculer la concentration molaire de l’acide sulfurique (VI) sachant que sa concentration en pourcentage est C p = 98,0 %et sa masse volumique est d = 1,84 kg/dm 3 . Celle-ci peut être calculée selon deux méthodes : Méthode 1. En quelques étapes, sans utiliser de formule Étape 1. Calcul de la masse de 1,00 dm 3 d’acide
La seule limite de la formule est l’utilisation d’unités appropriées, il vaut donc la peine de les prendre en compte dans tous les calculs. Exemple 5. Calculer la concentration molaire de l’acide sulfurique (VI) sachant que sa concentration en pourcentage est C p = 98,0 %et sa masse volumique est d = 1,84 kg/dm 3 . Celle-ci peut être calculée selon deux méthodes : Méthode 1. En quelques étapes, sans utiliser de formule Étape 1. Calcul de la masse de 1,00 dm 3 d’acide 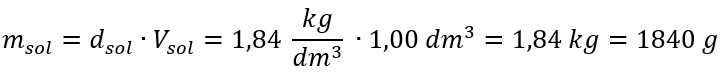 Étape 2. Calcul de la masse de l’acide en tenant compte du pourcentage de concentration
Étape 2. Calcul de la masse de l’acide en tenant compte du pourcentage de concentration 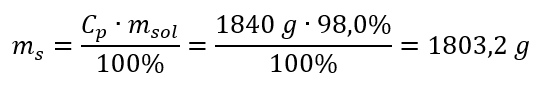 Étape 3. Calcul du nombre de grains de beauté
Étape 3. Calcul du nombre de grains de beauté 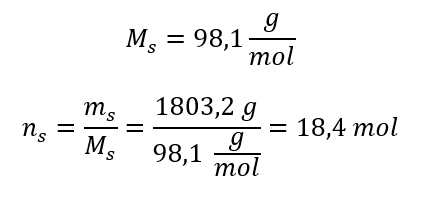 Etape 4. Calcul de la concentration molaire sachant qu’il s’agit du nombre de moles de la substance dans 1 dm 3 de la solution
Etape 4. Calcul de la concentration molaire sachant qu’il s’agit du nombre de moles de la substance dans 1 dm 3 de la solution 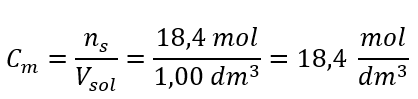 Méthode 2. Utilisation de la relation entre la concentration en pourcentage et la concentration molaire
Méthode 2. Utilisation de la relation entre la concentration en pourcentage et la concentration molaire 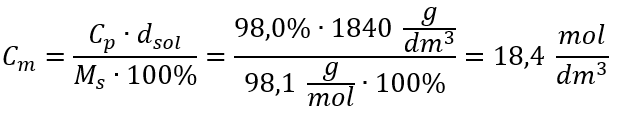 Réponse : La concentration molaire de cet acide est de 18,4 mol/dm 3 .
Réponse : La concentration molaire de cet acide est de 18,4 mol/dm 3 .
