La dissociation, dans le contexte chimique, signifie la décomposition d'une substance en d'autres molécules. Le mot vient du terme latin « dissociatio », signifiant « séparation ». Dans la nomenclature scientifique, la dissociation a diverses définitions, car elle a aussi sa signification spécifique en psychologie. Mais concentrons-nous sur ce que la dissociation signifie en chimie. Selon le déroulement du processus et la substance utilisée, on peut distinguer quatre types de dissociation différents. Le plus populaire est la dissociation électrolytique, bien que la dissociation thermique soit tout aussi importante.

Dissociation thermique
Le processus consiste en la décomposition de molécules en molécules plus petites ou en atomes, sous l’influence de la température. La relation la plus importante est le fait que la température utilisée pour la dissociation peut être inférieure si le composé comprend des liaisons chimiques plus faibles. Ceux qui ont une énergie plus élevée nécessaire à la décomposition nécessitent une température plus élevée. Un exemple courant de thermolyse (dissociation thermique) est la caramélisation du saccharose, qui se produit à 160 o C.
Dissociation électrolytique
Découvert en 1887 par le chimiste suédois Svante Arrhenius, il est un peu plus complexe que la dissociation thermique. La dissociation électrolytique consiste en la décomposition d’une substance, qui se produit lorsqu’un solvant (généralement de l’eau) affecte des ions en mouvement libre. Arrhenius a prouvé dans ses recherches que les ions produits par une telle dissociation amènent la solution à conduire l’électricité. Ce fut la base pour développer la classification des substances chimiques en électrolytes (solutions capables de conduire le courant électrique) et non-électrolytes (solutions non capables de conduire le courant électrique).
Électrolytes
Le terme "électrolytes" a deux significations – du point de vue technique, c’est toute substance qui peut transférer ioniquement une charge entre les électrodes. En conséquence, il peut conduire ioniquement le courant électrique. L’autre sens, plus chimique, de ce terme fait référence à des substances qui subissent une dissociation électrolytique à la suite d’une fusion ou d’une dissolution. De telles solutions (le plus souvent aqueuses) conduisent également l’électricité. Des exemples de tels électrolytes comprennent des composés ioniques, tels que le chlorure de sodium (sel de table), mais également des composés non ioniques, comme par exemple l’acide chlorhydrique ou l’hydroxyde de potassium . Compte tenu de leurs propriétés spécifiques, les électrolytes peuvent être appelés conducteurs électriques. Ceux-ci peuvent être divisés en conducteurs de classe 1 (métaux, leurs alliages et carbone) et conducteurs de classe 2 (solutions de bases, d’acides et de sels ).
Le mécanisme de la dissociation électrolytique
Dans un solvant dont la constante diélectrique est élevée (par exemple 81 pour l’eau), les forces d’attraction mutuelle entre les ions d’un réseau cristallin sont considérablement réduites. C’est à ce moment que les ions se détachent, ce qui provoque la dissolution de la substance et la sécrétion d’ions en mouvement libre dans la solution. De tels processus se produisent également en raison de l’interaction entre les ions et les molécules d’eau, qui est une conséquence d’une structure polaire de H 2 O. Selon Nekrasov, le mécanisme d’action de l’eau lors de la décomposition d’un électrolyte à structure ionique est déclenché par l’ion positif de la substance, qui attire le pôle opposé de la molécule d’eau, tout en repoussant l’ion positif. Le pôle opposé agit de la même manière et les deux ions sont entourés par les molécules d’eau qu’ils ont attirées. Une telle attraction se produit dans les deux sens entre les molécules dipolaires et les ions, ce qui rend la force d’attraction des ions dans l’électrolyte beaucoup plus faible. Ainsi, le mécanisme peut être divisé en quatre étapes principales : la transition de la structure polaire à la structure ionique, la formation de la structure ionique et l’hydratation des ions. Les liaisons entre les ions et le solvant, produites par dissociation, sont appelées solvates. Si l’eau est le solvant, on les appelle alors des hydrates.
La coque d’hydratation
C’est une coquille composée de molécules d’eau existant au plus près de l’ion, orientées avec leurs pôles opposés. Les pôles libres et chargés attirent d’autres couches d’eau, jusqu’à ce que la force d’attraction de l’ion devienne plus faible que l’énergie de mouvement moléculaire dans la solution. La coque facilite la décomposition des molécules d’électrolyte en cations et anions, et constitue une barrière qui empêche la re-liaison des ions pour former des molécules. 
Dissociation des acides et des bases : la loi de l’action de masse
Les acides forts sont les acides qui présentent une dissociation profonde dans une solution aqueuse, et les acides faibles sont ceux qui ne se dissocient que dans une faible mesure. Si nous comparons la force de différents acides, nous devons également prendre en compte quelques facteurs tels que la tendance des molécules d’acide à céder leurs protons ou la concentration de la substance en question. Cependant, il existe une valeur chimique qui ne dépend pas de la concentration mais caractérise parfaitement les propriétés individuelles des molécules – la constante de dissociation. La dérivation de l’équation pour cette valeur doit être commencée par l’écriture de l’équation de la dissociation acide . Pour un exemple avec un seul proton (HX), cela ressemblera à ceci : ![]() Si la solution est diluée et que l’acide est faible, on peut appliquer la loi d’action de masse, qui s’exprime comme suit :
Si la solution est diluée et que l’acide est faible, on peut appliquer la loi d’action de masse, qui s’exprime comme suit : 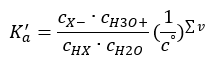 Il existe deux manières de raccourcir la relation présentée. La première étape consiste à supposer que la concentration en eau est constante. On peut également omettre le symbole c o , car il exprime une concentration standard égale à 1 mol/dm 3 . Cependant, il est important de le placer dans la formule initiale et d’en tenir compte lors de la détermination de l’unité. En effet, les constantes chimiques sont des valeurs sans dimension. Cependant, toutes les concentrations utilisées dans la formule sont exprimées en mol/dm 3 . Puis on obtient finalement la formule de la constante de dissociation :
Il existe deux manières de raccourcir la relation présentée. La première étape consiste à supposer que la concentration en eau est constante. On peut également omettre le symbole c o , car il exprime une concentration standard égale à 1 mol/dm 3 . Cependant, il est important de le placer dans la formule initiale et d’en tenir compte lors de la détermination de l’unité. En effet, les constantes chimiques sont des valeurs sans dimension. Cependant, toutes les concentrations utilisées dans la formule sont exprimées en mol/dm 3 . Puis on obtient finalement la formule de la constante de dissociation : 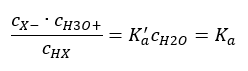 La relation exprimant la constante de dissociation acide (K a ) est constituée de valeurs déterminées expérimentalement, comprises entre 10 -10 et 10 8 . Une opération courante consiste à utiliser une formule logarithmique, exprimée sous la forme d’un logarithme négatif de la constante de dissociation, désignée par pK a : pK a = -logK a Il est important que les valeurs faibles de K a représentent des acides faibles et que les valeurs élevées représentent des acides forts , le pKa évolue dans le sens inverse. Des valeurs de pKa faibles, généralement négatives, correspondent à des acides forts. Des valeurs de pKa positives et élevées représentent des acides faibles. Lorsque nous introduisons un autre concept, le degré de dissociation (α), qui est le rapport du nombre de moles des molécules d’un composé donné, qui subissent une dissociation (décomposition en ions), au nombre total de moles des molécules de ce composé, présent dans la solution, nous pouvons développer davantage l’équation. Si nous ne tenons pas compte de la très faible concentration d’ions hydrogène formés par la dissociation de l’eau et utilisons les concentrations d’équilibre des ions et des molécules, nous pouvons supposer que :
La relation exprimant la constante de dissociation acide (K a ) est constituée de valeurs déterminées expérimentalement, comprises entre 10 -10 et 10 8 . Une opération courante consiste à utiliser une formule logarithmique, exprimée sous la forme d’un logarithme négatif de la constante de dissociation, désignée par pK a : pK a = -logK a Il est important que les valeurs faibles de K a représentent des acides faibles et que les valeurs élevées représentent des acides forts , le pKa évolue dans le sens inverse. Des valeurs de pKa faibles, généralement négatives, correspondent à des acides forts. Des valeurs de pKa positives et élevées représentent des acides faibles. Lorsque nous introduisons un autre concept, le degré de dissociation (α), qui est le rapport du nombre de moles des molécules d’un composé donné, qui subissent une dissociation (décomposition en ions), au nombre total de moles des molécules de ce composé, présent dans la solution, nous pouvons développer davantage l’équation. Si nous ne tenons pas compte de la très faible concentration d’ions hydrogène formés par la dissociation de l’eau et utilisons les concentrations d’équilibre des ions et des molécules, nous pouvons supposer que : 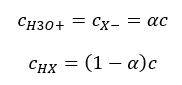 Alors la constante de dissociation peut être notée comme suit :
Alors la constante de dissociation peut être notée comme suit :  Sous cette forme, c’est la dépendance du degré de dissociation d’un électrolyte de sa concentration, c’est-à-dire la loi de dilution d’Ostwald. Si nous analysons des électrolytes très faibles, le degré de dissociation (α) peut être supposé égal à <<1, et la formule peut être simplifiée comme suit :
Sous cette forme, c’est la dépendance du degré de dissociation d’un électrolyte de sa concentration, c’est-à-dire la loi de dilution d’Ostwald. Si nous analysons des électrolytes très faibles, le degré de dissociation (α) peut être supposé égal à <<1, et la formule peut être simplifiée comme suit :  Les acides qui contiennent plus d’un proton subissent une dissociation en plusieurs étapes, et nous devons prendre en compte toutes ses étapes. A titre d’exemple, pour l’acide orthophosphorique il y a trois étapes :
Les acides qui contiennent plus d’un proton subissent une dissociation en plusieurs étapes, et nous devons prendre en compte toutes ses étapes. A titre d’exemple, pour l’acide orthophosphorique il y a trois étapes :
- H 3 PO 4 + H 2 O = H 2 PO 4 – + H 3 O +
- H 2 PO 4 – + H 2 O = HPO 4 2- + H 3 O +
- HPO 4 2- + H 2 O = PO 4 3- + H 3 O +
Chaque étape a sa propre constante d’équilibre, qui peut être notée de manière analogue à la première :  Les constantes de dissociation sont tabulées, à la fois pour les hydracides et pour les oxyacides.
Les constantes de dissociation sont tabulées, à la fois pour les hydracides et pour les oxyacides.
| Acide | Ka | pKa |
| HF | 6,3·10 -4 | 3.2 |
| HCl | 1·10 7 | -sept |
| HNO 3 | 27.54 | -1,44 |
| H 3 PO 4 | 6.9·10 -3 | 2.16 |
Tableau 1. Exemples de valeurs de constantes de dissociation pour les acides. Il en est de même pour la stabilisation de l’équilibre des bases lors de la dissociation. En considérant l’exemple de règle B, l’équation peut être notée comme suit : ![]() Ensuite, si l’on souhaite déduire une constante de dissociation pour une base, en utilisant la loi d’action des masses et en supposant que la concentration en eau dans la solution diluée est pratiquement constante, on obtient la formule suivante :
Ensuite, si l’on souhaite déduire une constante de dissociation pour une base, en utilisant la loi d’action des masses et en supposant que la concentration en eau dans la solution diluée est pratiquement constante, on obtient la formule suivante :  Plus la base est forte, plus la constante de dissociation est élevée et plus la valeur de pKb est faible, tandis que plus la constante de dissociation est faible et plus la valeur de pKb est élevée, plus la base est faible.
Plus la base est forte, plus la constante de dissociation est élevée et plus la valeur de pKb est faible, tandis que plus la constante de dissociation est faible et plus la valeur de pKb est élevée, plus la base est faible.
| Base | Kb | pK b |
| Hydrazine | 3·10 -6 | 5.5 |
| Ammoniac | 1,78·10 -5 | 4,75 |
| Méthylamine | 5.0·10 -4 | 3.3 |
Tableau 2. Exemples de valeurs de constantes de dissociation pour les bases. 
Qu’est-ce qui détermine la force des acides
Si nous connaissons les expressions des constantes de dissociation pour des acides particuliers, nous pouvons faire quelques hypothèses vraies :
- La force d’un hydracide augmente avec l’augmentation du numéro atomique de l’élément lié à l’atome d’hydrogène.
- La force d’un hydracide diminue avec l’électronégativité croissante de l’élément attaché à l’atome d’hydrogène. Cela peut être trompeur, car en théorie l’électronégativité croissante devrait favoriser l’abstraction des protons.
- La taille de l’anion formé lors de la dissociation affecte la constante de dissociation dans une plus large mesure que l’électronégativité.
Auto-dissociation de l’eau
Un exemple intéressant de dissociation est la décomposition des molécules d’eau. Puisqu’elles sont capables à la fois d’attirer des protons et de les céder, l’eau pure s’autodissocie dans une faible mesure, selon l’équation suivante : H 2 O + H 2 O ↔ H 3 O + + OH – Comme pour les acides et bases, il est également possible d’appliquer la loi d’action des masses, qui inclut les concentrations à l’équilibre de l’eau non dissociée ainsi que ses anions et cations : 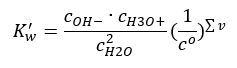 Il s’avère que les concentrations de cations H 3 O + et d’anions OH – sont si faibles par rapport à l’eau non dissociée que même leur altération ne modifie pratiquement pas la concentration de l’eau non dissociée. Cela permet de supposer que cette valeur est constante et de convertir l’équation sous la forme suivante : K w = c OH – · c H3O + C’est un aspect particulièrement important dans le cadre des calculs chimiques, et une telle constante est appelée comme le produit ionique de l’eau. Il est également souvent utilisé comme logarithme négatif, désigné par pK w . Ceci est égal à –logK w . Sur la base de l’équation, si l’équilibre ionique de l’eau est perturbé à la suite de l’apport d’ions H 3 O + , alors afin de maintenir la constance du produit ionique, nous devons réduire la concentration d’ions OH – . De même, un excès d’ions OH – réduit la concentration en cations. Le produit de ces concentrations doit être constant. Des expériences ont montré que K w à une température de 298K est de 10 -14 . Par conséquent, on peut aussi noter l’équation valable pour l’eau pure comme suit :
Il s’avère que les concentrations de cations H 3 O + et d’anions OH – sont si faibles par rapport à l’eau non dissociée que même leur altération ne modifie pratiquement pas la concentration de l’eau non dissociée. Cela permet de supposer que cette valeur est constante et de convertir l’équation sous la forme suivante : K w = c OH – · c H3O + C’est un aspect particulièrement important dans le cadre des calculs chimiques, et une telle constante est appelée comme le produit ionique de l’eau. Il est également souvent utilisé comme logarithme négatif, désigné par pK w . Ceci est égal à –logK w . Sur la base de l’équation, si l’équilibre ionique de l’eau est perturbé à la suite de l’apport d’ions H 3 O + , alors afin de maintenir la constance du produit ionique, nous devons réduire la concentration d’ions OH – . De même, un excès d’ions OH – réduit la concentration en cations. Le produit de ces concentrations doit être constant. Des expériences ont montré que K w à une température de 298K est de 10 -14 . Par conséquent, on peut aussi noter l’équation valable pour l’eau pure comme suit :  La dissociation est également liée à la valeur du pH de la solution. Des solutions avec des concentrations égales de cations H 3 O + et d’anions OH – présentent un pH neutre. Dans les solutions acides, la concentration des cations est supérieure à 10 -7 mol/l, tandis que dans les solutions alcalines, elle est inférieure à 10 -7 mol/l.
La dissociation est également liée à la valeur du pH de la solution. Des solutions avec des concentrations égales de cations H 3 O + et d’anions OH – présentent un pH neutre. Dans les solutions acides, la concentration des cations est supérieure à 10 -7 mol/l, tandis que dans les solutions alcalines, elle est inférieure à 10 -7 mol/l.
