En chimie, certains composés chimiques forment des liaisons spéciales avec les molécules d’eau. Il ne s’agit pas de liaisons chimiques, mais d’interactions à courte portée qui déterminent spécifiquement les propriétés de ces composés. Nous parlons d'hydrates. Leurs propriétés sont facilement utilisées dans des secteurs industriels sélectionnés. Le sel hydraté le plus populaire est sans aucun doute le gypse, ou sulfate de calcium dihydraté (VI), qui est une matière première importante dans l'industrie de la construction. Les hydrates sont également de très bons indicateurs de la teneur en humidité. Ceci est lié au fait que la couleur du sel anhydre est souvent différente de celle du sel hydraté.

Hydrate
Les hydrates ne sont pas des composés chimiques dans lesquels des liaisons chimiques , telles que des liaisons covalentes , se produisent entre les molécules d’eau et les molécules du sel donné . Ce ne sont pas non plus des composés de coordination. La formation de liaisons hydrogène, dont la résistance est beaucoup plus faible que les liaisons chimiques, est caractéristique de ces structures. Les hydrates sont structurés sous la forme d’un réseau cristallin. Les molécules d’eau y sont irrégulièrement réparties. Le terme « eau de cristallisation » est souvent utilisé. Les hydrates sont obtenus par hydratation . Les molécules de sel, en particulier les dérivés d’acides inorganiques, sont les plus susceptibles de subir cette réaction. L’hydratation implique la transformation de cristaux anhydres en cristaux hydratés. Cela peut provoquer une modification de la masse minérale, mais ne la détruit pas. L’hydratation accompagne souvent d’autres processus, comme la carbonatation. Les produits chimiques d’hydratation, dans des conditions normales, se caractérisent par une hygroscopique élevée , c’est-à-dire une forte affinité pour les molécules d’eau. De telles substances sont capables, par exemple, d’ absorber l’humidité de l’air . Une autre façon d’obtenir des hydrates consiste à les cristalliser à partir de solutions aqueuses. Les formules moléculaires des hydrates sont formées en notant la formule du sel et en indiquant le nombre de molécules d’eau hydratées. Afin de fournir une notation générale, la lettre « n » est placée avant « H 2 O ». Ses valeurs sont supérieures à un et correspondent au nombre de molécules d’eau attachées. Les distinctions les plus courantes sont entre les hydrates avec n=½ (hémihydrate), n= 1 (monohydrate), n=2 (dihydrate) et n=3 (trihydrate). Il est important de noter que la même substance peut attacher différents nombres de molécules d’eau. ![]()
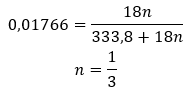 Étant donné qu’il existe des liaisons hydrogène entre les molécules de sel et les molécules d’eau, ces composés ne présentent pas une résistance satisfaisante aux températures élevées. Lorsqu’ils sont chauffés, ils se désintègrent et se transforment en formes anhydres. Les hydrates se dissolvent très bien dans l’eau. Dans les solutions aqueuses, les molécules d’eau hydratées attachées au sel sont libérées. Ce fait doit être pris en compte, par exemple, lors de la préparation de solutions de ces substances. Ne pas prendre en compte le degré d’hydratation d’un composé donné entraîne des erreurs, ne serait-ce que dans la détermination de la concentration de la solution. Une caractéristique importante des sels hydratés est le changement de couleur dû à la fixation des molécules d’eau dans la réaction d’hydratation. Il convient de noter que les formes hydratées présentent une hygroscopique nettement moindre par rapport aux sels anhydres.
Étant donné qu’il existe des liaisons hydrogène entre les molécules de sel et les molécules d’eau, ces composés ne présentent pas une résistance satisfaisante aux températures élevées. Lorsqu’ils sont chauffés, ils se désintègrent et se transforment en formes anhydres. Les hydrates se dissolvent très bien dans l’eau. Dans les solutions aqueuses, les molécules d’eau hydratées attachées au sel sont libérées. Ce fait doit être pris en compte, par exemple, lors de la préparation de solutions de ces substances. Ne pas prendre en compte le degré d’hydratation d’un composé donné entraîne des erreurs, ne serait-ce que dans la détermination de la concentration de la solution. Une caractéristique importante des sels hydratés est le changement de couleur dû à la fixation des molécules d’eau dans la réaction d’hydratation. Il convient de noter que les formes hydratées présentent une hygroscopique nettement moindre par rapport aux sels anhydres.
Hydrates de composés inorganiques
Les sels d’ acides inorganiques sont des substances de loin les plus susceptibles de former des hydrates avec les molécules d’eau. Les hydrates de composés inorganiques les plus courants comprennent :
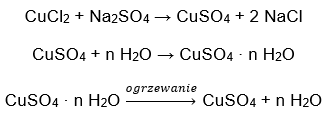
- Le sulfate de cuivre (II) hydraté (VI), CuSO 4 – le sulfate de cuivre (II) (VI) adopte différents degrés d’hydratation. Le nombre maximum de molécules d’eau attachées est de cinq. En chauffant le pentahydrate de ce sel, les molécules d’eau sont éliminées. Deux premiers et un trihydrate sont formés, et en chauffant davantage le système, du sulfate de cuivre (II) monohydraté (VI) peut être obtenu. Pour éliminer la dernière molécule d’eau, il est nécessaire de chauffer le composé à une température supérieure à 200 ᵒC. Les sulfates de cuivre (II) hydratés (VI) sont de couleur bleue, causée par la présence d’eau de cristallisation autour des ions cuivre. Alors que le sel anhydre est de couleur blanche. Sa haute hygroscopique et sa capacité à former des hydrates sont utilisées pour éliminer l’humidité de certains liquides.
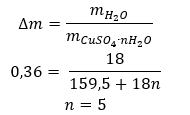
- Le chlorure de cobalt (II) hydraté, CoCl 2 – le chlorure de cobalt (II) anhydre est hautement hygroscopique. Grâce à sa forte affinité pour les molécules d’eau, il est capable d’absorber l’humidité même de l’air. Ce processus aboutit à la formation d’hydrates de ce sel. La forme hydratée la plus courante est le chlorure de cobalt (II) hexahydraté – CoCl 2 * 6H 2 Une autre forme est la molécule dihydratée. Ce sel présente également la capacité de changer de couleur en fonction de sa teneur en humidité. Le sel anhydre est bleu, le dihydraté prend une couleur violet rosé et la couleur de la molécule hexahydratée est rouge intense.
- Sulfate de sodium hydraté (VI), Na 2 SO 4 – ce sel existe sous forme de deux hydrates : heptahydraté (cinq molécules d’eau dans la structure) et décahydraté (dix molécules d’eau dans la structure). La forme anhydre du sulfate de sodium (VI) est présente dans la nature sous forme de thénardite, un minéral rare. Le sulfate de sodium dixhydraté (VI) est ce qu’on appelle le sel de Glauber. Il est largement utilisé dans la production de verre, de papier, de lessive et de soude. Le sel de Glauber est également l’un des ingrédients nécessaires à la production du pigment bleu outremer. De plus, le composé a un effet thérapeutique sur le système digestif, grâce à ses propriétés laxatives.

Gypse
Un exemple d’hydrate de sel inorganique d’importance mondiale et de large application est le gypse. C’est un minéral constitué de la forme hydratée de sulfate de calcium (VI), CaSO 4 . Le gypse cristallin est le dihydrate de ce sel. Dans des conditions naturelles, il se forme lors de l’évaporation de l’eau salée des lacs et des rivières, à des températures inférieures à 42ᵒC. Le sulfate de calcium anhydre (VI) est de l’anhydrite. On l’appelle également gypse anhydre. Le gypse de construction, quant à lui, est du sulfate de calcium hémihydraté (VI). La forme de ce sel obtenue dépend de la température régnant lors du traitement de la roche sédimentaire mère. Le gypse utilisé dans la construction est généralement un mélange de différentes formes de sel de chaux hydratée. 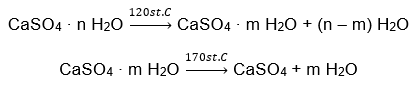
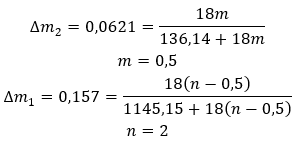 Les possibilités d’application du plâtre sont très larges, notamment dans le secteur de la construction. Les utilisations les plus importantes de ce sel hydraté sont énumérées ci-dessous :
Les possibilités d’application du plâtre sont très larges, notamment dans le secteur de la construction. Les utilisations les plus importantes de ce sel hydraté sont énumérées ci-dessous :
- Dans le secteur de la construction, le gypse est utilisé dans les éléments de finition. Il entre dans la composition de produits semi-finis en vrac, de mortiers, de colles, de finitions à base de plâtre et de composants d’assemblage prêts à l’emploi, par exemple les plaques de plâtre.
- La médecine utilise du plâtre pour soigner les membres cassés. Les bandages en plâtre sont considérés comme doux pour la peau. De plus, le matériau est également utilisé dans les laboratoires de technologie dentaire.
- L’industrie utilise le gypse dans les ateliers de modélisation et de conception. Les moulages en plâtre conviennent très bien pour façonner divers objets utilitaires.
- Le gypse est un additif à certains engrais utilisés en agriculture.

Clathrates de méthane
Les clathrates de méthane appartiennent à un groupe de composés appelés hydrates de gaz. Ils sont responsables de la majeure partie du changement climatique rapide de l’histoire de la Terre. Les clathrates de méthane sont également souvent appelés hydrates de méthane ou glace de méthane. Ils forment une forme solide d’eau et de méthane . Leurs molécules se distinguent par leur structure cristalline. Ils se forment sous une pression accrue. Ils se présentent sous la forme de solides blancs et inodores, qui s’apparentent souvent, en termes d’aspect extérieur, à la glace. Fait intéressant, ils ressemblent au polystyrène au toucher. Les clathrates sont des groupements chimiques uniques . Les molécules d’eau forment une structure qui ressemble à une cage. Le méthane est stocké à l’intérieur de cette cage. Il est important de noter que les deux substances ne forment pas de liaisons chimiques entre elles. En règle générale, les clathrates de méthane sont constitués de 46 molécules d’eau entourant deux cages de petite et six cages de taille moyenne. Des molécules de méthane y sont piégées. Les clathrates sont également connus pour être constitués de 136 molécules d’eau contenant 16 petites et huit grandes cages de méthane. Ces dernières années, des quantités importantes de cette ressource ont été découvertes au fond des océans. Il suscite beaucoup d’intérêt en raison du potentiel d’extraction d’importantes quantités de méthane, qui peuvent être utilisées, par exemple, à des fins énergétiques. Les clathrates de méthane brûlent avec une flamme uniforme, de couleur rougeâtre. Après la combustion, il reste de l’eau fondue. Le méthane ainsi extrait peut constituer une bonne alternative aux sources d’hydrocarbures conventionnelles, mais il constitue également une menace considérable pour le climat. Les connaissances sur l’exploitation du méthane issu des clathrates accumulés au fond des océans sont encore insuffisantes. Le rejet incontrôlé de quantités importantes de ce gaz peut être très dangereux, car il renforce l’effet de serre bien plus fortement que le dioxyde de carbone.
