Le terme «élément» fait référence aux atomes dont les noyaux contiennent un nombre particulier de protons. En dehors d'eux, un noyau atomique est également constitué d'autres molécules : les neutrons. Leur nombre au sein d'un même élément peut varier. Dans un tel cas, on parle d'isotopes, c'est-à-dire de variantes d'un élément donné qui ont des nombres différents de neutrons dans leur noyau. Ainsi, leurs nombres de masse sont également différents. Cependant, le numéro atomique reste constant, car le nombre d'électrons sur les couches d'électrons reste limité.

Pour cette raison, les isotopes d’un même élément ont la même position dans le tableau périodique et chacun d’eux à la même taille. De plus, leurs propriétés chimiques et physiques sont similaires. Cependant, il existe des exceptions où surtout les propriétés physiques sont plus diversifiées, ce qui se produit généralement lorsque nous traitons de deux isotopes avec des différences de masse importantes. Cela est dû au fait que c’est la masse qui détermine toute une gamme de propriétés telles que la densité ou la vitesse de diffusion des particules. En revanche, des paramètres tels que la conductivité électrique ou la couleur ne dépendent pas de la masse. La diversité des propriétés chimiques provient normalement des vitesses de réaction inégales des divers isotopes.
Nuclides vs isotopes
Il existe un concept associé aux isotopes, qui est plus générique. Un nucléide est un ensemble complet d’atomes dont la structure nucléaire est fournie par le nombre de protons et de neutrons. Cela signifie que deux nucléides qui diffèrent par le nombre de neutrons peuvent être des isotopes. En pratique, tous les isotopes sont des nucléides mais tous les nucléides ne sont pas nécessairement des isotopes. L’idée principale derrière ces deux concepts couvre les propriétés chimiques dans le cas des isotopes et les propriétés nucléaires dans le cas des nucléides. Par exemple:
- Nuclides qui sont des isotopes :
- Nuclides qui ne sont pas des isotopes :
Isotopes dans la nature
Les éléments chimiques existant dans l’environnement naturel sont un mélange d’isotopes avec une composition en pourcentage constant. Selon le noyau, un élément peut contenir un, plusieurs ou plusieurs isotopes. Certains d’entre eux sont stables, mais certains se transforment rapidement. Une telle décomposition peut produire des isotopes du même élément ou d’un élément différent. De telles transitions accompagnent généralement l’émission de rayonnement. Pour utiliser des valeurs particulières, il existe sur Terre des éléments dont les numéros atomiques sont égaux ou inférieurs à 92. Ceux dont les numéros vont jusqu’à 83 sont considérés comme stables. Il existe jusqu’à 81 éléments naturels qui ont des isotopes stables. Il s’agit notamment du silicium, avec les isotopes 28 Si, 29 Si et 30 Si, du fer, avec les isotopes 54 Fe, 56 Fe, 57 Fe et 58 Fe, ou de l’aluminium, qui n’a qu’ un seul isotope stable : 27 Al.
Isotopes de l’hydrogène
Dans la nature, nous pouvons trouver trois isotopes d’hydrogène qui forment un mélange d’éléments. En pratique, les isotopes 1 H (hydrogène-1) et 2 H (hydrogène-2) représentent respectivement majoritairement 99,985 %et 0,015 %de l’occurrence totale de l’hydrogène. L’isotope 3 H (hydrogène-3) est instable et ne représente que des traces. L’hydrogène-1 est le protium le plus connu, l’hydrogène-2 (également appelé deutérium) est composé d’un proton et d’un neutron, tandis que le noyau du dernier isotope (hydrogène-3, c’est- à-dire le tritium) contient un proton et deux neutrons. Pour cette raison, la différence de masse entre ces isotopes est importante : l’atome de deutérium est deux fois plus lourd que celui de protium, tandis que le tritium est même trois fois plus lourd que le protium. Comme nous le savons, l’hydrogène sous n’importe quelle forme isotopique existe en tant que molécule diatomique. Il s’avère qu’il peut également former des molécules contenant différents isotopes, à savoir HD (protium-deutérium), HT (protium-tritium) et DT (deutérium-tritium). Le deutérium est un isotope non radioactif à haute stabilité. Il est parfois appelé hydrogène lourd. Si nous remplaçons l’hydrogène-1 par du deutérium dans une molécule d’eau (D 2 O), la molécule changera de propriétés : le point de fusion augmentera d’environ 1,5 o C et le point de congélation diminuera jusqu’à’ à 3,81 o C. Sa densité augmente également par rapport à H 2 O d’environ 0,1 %. En revanche, le tritium est un isotope hautement instable qui est également radioactif. Son noyau est un lieu de décompositions radioactives spontanées qui produisent des atomes d’hélium. Si nous comparons les propriétés physico-chimiques des isotopes, nous trouverons des différences essentielles, qui sont présentées dans le tableau 1. Tableau 1. Comparaison des paramètres physico-chimiques de base des isotopes de l’hydrogène.
| Isotope | Symbole | Densité [g /l] | Point de fusion [K] | Point d’ébullition [K] |
| protium | H | 0,08233 | 13.83 | 20.27 |
| Deutérium | concernant | 0,1645 | 18.73 | 23.67 |
| Tritium | J | 0,2464 | 20.62 | 25.04 |
Isotopes du carbone
Le carbone a trois isotopes connus : 12 C, 13 C et 14 C, chacun d’eux ayant les mêmes propriétés chimiques. Le plus courant est le carbone 12, qui représente jusqu’à 98,89 %de tous les atomes. L’isotope 13 C existant sur Terre représente environ 1,11 %, tandis que l’atome 14 C est présent en un par 10 12 environ. Ce dernier est prédisposé à une décomposition spontanée, ce qui provoque l’émission de rayonnement bêta. Ensuite, l’isotope se transforme en un atome d’azote. Un isotope stable est le carbone 13. Du fait de son spin non nul, il peut être appliqué en résonance magnétique nucléaire 13 RMN.
Application des isotopes
Dans les détecteurs de fumée, on use des isotopes instables, 241 Am ou 238 Pu, qui se caractérisent par une décomposition lente combinée à l’émission de rayonnement. Lorsque la fumée apparaît, le rayonnement est bloqué et n’atteint plus le détecteur, déclenchant ainsi l’alarme. Le rayonnement de décomposition de certains éléments est capable de détruire les micro-organismes, et donc les isotopes, dont le 60 Co, peut être utilisé pour la conservation des aliments. Dans le diagnostic médical, certains noyaux sont utilisés pour détecter des changements dans les organes testés, par exemple dans les rênes ou dans le cœur. Un tel isotope se combine avec une substance biologiquement inactive avec un chemin connu dans le corps et l’introduit dans le système de circulation sanguine. Cela permet de suivre le trajet du rayonnement et d’observer son accumulation dans les tissus et les organes. Dans le traitement des tumeurs, on applique également la radiothérapie basée sur l’émission de rayonnement par des isotopes instables tels que le 226 Ra et le 60 Co. Le but d’une telle thérapie est de détruire les cellules tumorales. L’un des isotopes du carbone, le 14 C, est appliqué pour doser l’âge des matériaux d’origine organique. Ce noyau instable se décompose lentement, et si l’organisme meurt (ce qui correspond à l’arrêt de l’assimilation du carbone), sa concentration en carbone 14 diminue au fur et à mesure des années qui passent. Certains isotopes, par exemple 239 Pu et 235 U, sont utilisés dans les centrales nucléaires. Lors de la décomposition de ces noyaux instables, de l’énergie est produite qui à son tour peut être convertie en électricité.
Masse atomique et isotopes
La masse atomique des éléments présentés dans le tableau périodique est en fait la masse moyenne. Lorsque nous le calculons, nous prenons en compte le nombre (n) et la composition en pourcentage (x n ) de chaque isotope de l’élément en question, selon la formule suivante : 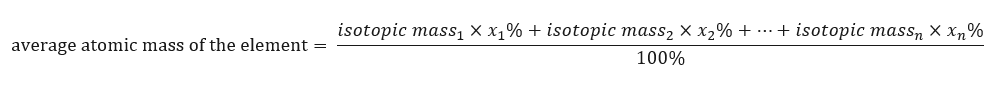 Par exemple, lors du calcul de la masse atomique moyenne de l’hydrogène, nous obtiendrons l’équation suivante :
Par exemple, lors du calcul de la masse atomique moyenne de l’hydrogène, nous obtiendrons l’équation suivante : 
