L'énergie des réactions chimiques est l'un des éléments importants qui nous permettent de comprendre les transformations qui se produisent dans une réaction chimique. Lors d'une telle transformation, des composés chimiques sont produits avec une structure et une composition chimique différentes de celles des matières premières qui les composent. Au cours d'une réaction chimique, les liaisons existant entre les atomes des molécules utilisées comme réactifs sont rompues et de nouvelles liaisons sont créées, présentes dans les produits.

Le système et l’environnement d’une réaction chimique
Pour interpréter correctement une réaction chimique en termes d’énergie, nous devons avoir quelques connaissances sur les éléments suivants :
- Système : une zone de matière séparée avec des limites claires. Le type de système est important : il est ouvert si la réaction implique un échange d’énergie et de matière, fermé si la réaction implique uniquement un échange d’énergie, ou isolé si ni énergie ni matière ne sont échangées.
- Environnement : tout ce qui n’est pas inclus dans le système mais qui se trouve à proximité.
- Composants du système : toutes les substances qui se trouvent dans le système analysé et qui ont leurs propriétés chimiques caractéristiques.
L’énergie des liaisons chimiques
L’effet énergétique qui caractérise toute réaction chimique est le résultat de changements se produisant lors de la rupture et de la production de nouvelles liaisons entre les atomes. En effet, chaque rupture d’une liaison chimique est intrinsèquement liée à l’absorption d’une quantité appropriée d’énergie, tandis que la formation d’une nouvelle liaison provoque la production d’énergie. La libération d’énergie dans l’environnement peut avoir différents effets : chaleur, lumière, travail ou électricité. Chacun de ces processus est un facteur composant qui affecte le changement général de l’énergie interne du système dans lequel la réaction a lieu. Il est important que, indépendamment du fait que les réactifs doivent puiser ou abandonner de l’énergie pendant la transformation, une certaine quantité d’énergie est toujours nécessaire pour initier l’ensemble du processus.
La première loi de la thermodynamique
La première règle importante concernant l’énergie des réactions chimiques est la relation formulée dans la première loi de la thermodynamique, stipulant que l’énergie interne d’un système qui n’échange de l’énergie qu’avec l’environnement (un système fermé) ne peut être transformée qu’en chaleur ou en travail. Cela se reflète dans l’équation de Helmholtz : ∆U = Q + W où ΔU désigne le changement d’énergie interne, Q désigne la chaleur et W désigne le travail. On peut remarquer à partir de la formule que l’énergie interne d’un système isolé, c’est-à-dire qui n’échange pas d’énergie ou de masse avec l’environnement, est constante. Les composants de l’énergie interne sont toutes les énergies cinétiques des atomes, des ions, des molécules, des électrons et des composants du noyau atomique, qui sont actuellement dans le système de réaction, ainsi que les énergies de leurs interactions, c’est-à-dire les énergies des liaisons chimiques, des interactions entre les charges, etc. Veuillez noter que l’énergie interne ne contient pas l’énergie cinétique ou potentielle du système dans son ensemble. La somme des énergies cinétique et potentielle du système dans son ensemble et de l’énergie interne est l’énergie totale du système (E).
Enthalpie du système (H)
C’est un autre concept important lié à l’énergie des réactions chimiques, qui signifie en pratique la somme de l’énergie interne du système et le produit de sa pression et de son volume. En termes qualitatifs, c’est l’énergie nécessaire pour produire un système dans le vide (U), augmentée du travail, c’est-à-dire le quotient de la pression et du volume (pV), que le système doit fournir aux forces extérieures pour atteindre un volume différent de zéro. La relation définissant l’enthalpie d’un système s’exprime comme suit : H = U + pV Une réaction se produisant dans un tel système provoque une variation infiniment petite de l’enthalpie : dH = dU + dpV + pdV Si les conditions de réaction sont isobares, donc si la pression pendant le processus ne change pas, la deuxième partie peut être omise, car dpV=0. Après avoir remplacé les différentiels par des incréments définis et après avoir remplacé l’expression se référant au changement de l’énergie interne du système, nous obtenons la relation suivante : ∆H = Q + W + p∆V En supposant que le processus analysé effectue un travail volumétrique à une pression constante , alors W = -pΔV, et par conséquent : ∆H = Q – p∆V + p∆V Il résulte de l’équation que si la réaction se produit à pression constante, alors la variation de l’enthalpie du système est égale à la chaleur : ∆H = Q
Capacités énergétiques d’une réaction
Sur la base de la formule dérivée ci-dessus, qui indique que la variation de l’enthalpie du système peut être égale à la chaleur de la réaction, les processus sont classés en fonction des transformations thermiques. En termes de direction du flux d’énergie, nous divisons les réactions chimiques en :
- Les réactions exothermiques, qui sont de telles réactions où l’on peut observer l’émission d’énergie, par exemple sous forme de chaleur, vers l’environnement du système. Cela se produit lorsque la somme des enthalpies des produits est inférieure à la somme des enthalpies des substrats, donc lorsque ΔH<0.
- Réactions endothermiques, donc telles réactions chimiques qui provoquent l’absorption d’énergie de l’environnement. Une condition pour une telle réaction est de fournir une quantité appropriée de cette énergie. Ceci s’applique à toutes les transformations pour lesquelles l’enthalpie totale des produits est supérieure à l’enthalpie totale des substrats, donc ΔH > 0.
Notations de réactions chimiques
Compte tenu des réactions chimiques ainsi que de leur demande et de leur distribution d’énergie, leurs effets thermiques spécifiques sont inclus dans la notation d’une équation chimique. Pour les réactions exothermiques, la valeur absolue de l’effet thermique existant est notée côté produit. A l’inverse, lors du relevé d’une réaction endothermique, la valeur absolue de l’énergie absorbée est notée côté substrat. Pour donner un exemple :
- Réaction exothermique:
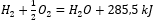
- Réaction endothermique : 2H 3 PO 4 + 3Mg(OH) 2 + 407kJ = Mg 3 (PO 4 ) 2 + 6H 2 O
Une autre façon consiste à noter une équation chimique avec la valeur de l’effet énergétique donnée de côté. Dans ce cas, la valeur représentant l’énergie d’une réaction exoénergique est négative, alors qu’elle est positive pour une réaction endoénergique. Par exemple:
- Réaction exoénergique : Fe + S → FeS ∆H= -95,2 kJ/mol
- Réaction endoénergique : FeS → Fe + S ∆H= 95,2 kJ/mol
Loi de Hess
Il constitue une base pour les calculs thermochimiques, affirmant que l’effet thermique est toujours le même quelle que soit la manière dont la réaction est effectuée. Cela nous permet de calculer l’enthalpie standard d’une réaction (Δ r H ϴ ), en supposant l’utilisation de conditions standard, c’est-à-dire une pression de 10 5 Pa et une température quelconque. L’enthalpie étant fonction de l’état, sa variabilité ne dépend que de deux valeurs : dans les états initial et final, qui dans une réaction chimique représentent respectivement l’état des substrats et l’état des produits. La loi de Hess s’exprime par une équation qui contient des coefficients stéchiométriques (v) et des enthalpies molaires standard de formation (Δ f H ϴ ) : 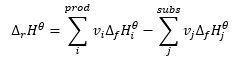
Enthalpie molaire standard de formation
C’est une enthalpie obtenue en formant 1 mole d’un composé chimique particulier à partir d’éléments dans leurs états basiques. L’état de base est la variante la plus durable de l’élément dans des conditions spécifiques. Pour donner un exemple, le graphite est la variante la plus durable du carbone à 25 o C et 10 5 Pa. Inversement, à température et pression élevées, une forme stable de carbone est le diamant. Pour chaque réactif qui participe à une réaction dans son état de base, la valeur de l’enthalpie molaire standard de formation est nulle. Il s’agit généralement d’atomes individuels de gaz nobles ou des variantes les plus durables d’autres gaz dans des conditions spécifiques. Pour une pression (10 5 Pa) et une température (normalement 25 o C) standard, les valeurs des enthalpies molaires standard de formation des composés sont rassemblées dans des tableaux chimiques. L’unité de cette valeur est . La loi de Hess appliquée aux réactions chimiques implique que la valeur d’enthalpie de la réaction est indépendante du nombre de réactions intermédiaires. La seule information clé est que des substrats particuliers sont utilisés pour obtenir des produits particuliers.
La synthèse du dioxyde de carbone
La synthèse du dioxyde de carbone peut être réalisée de différentes manières, mais selon la loi de Hess, chacune d’entre elles conduit à la même valeur de changements d’enthalpies standard.
- Synthèse directe
- La synthèse d’oxyde de carbone (II) + oxydation du composé en oxyde de carbone (IV)
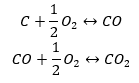 Lorsque nous lirons les valeurs des enthalpies standard de formation des composés du tableau et que nous les substituerons dans les équations chimiques, nous verrons que l’enthalpie pour chaque méthode est la même : -393,5 kJ/mol.
Lorsque nous lirons les valeurs des enthalpies standard de formation des composés du tableau et que nous les substituerons dans les équations chimiques, nous verrons que l’enthalpie pour chaque méthode est la même : -393,5 kJ/mol.
La loi de Kirchhoff
Il nous permet de transformer les calculs afin de calculer l’enthalpie standard d’une réaction pour une certaine température, si nous connaissons sa valeur à une température différente. Nous connaissons également les relations entre la chaleur molaire de tous les réactifs et la température. La loi peut être appliquée, car la variation de l’enthalpie de la réaction dépend des conditions dans lesquelles elle a été déterminée : elle varie en fonction de la température et de la pression. La dérivation de la formule doit commencer par définir la capacité thermique, c’est-à-dire le rapport de la chaleur fournie à l’élévation de température : ![]() En supposant des conditions isothermes, nous pouvons faire la transformation suivante :
En supposant des conditions isothermes, nous pouvons faire la transformation suivante : ![]() L’intégration de l’équation résultante et la conversion de la capacité thermique dans la partie représentant le changement de capacité thermique standard est reflétée par l’équation fournie par la loi de Kirchhoff :
L’intégration de l’équation résultante et la conversion de la capacité thermique dans la partie représentant le changement de capacité thermique standard est reflétée par l’équation fournie par la loi de Kirchhoff : 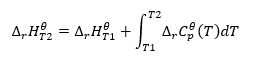 Pour des conditions standard, la variation de la capacité thermique d’une réaction est définie par l’équation avec les variables v, étant des facteurs stéchiométriques, et , qui représente la chaleur molaire standard d’un réactif donné. Lorsque la différence de température est faible (jusqu’à 100K), la valeur de la chaleur molaire standard du réactif est supposée constante dans une certaine plage. On peut alors utiliser la forme simplifiée de la loi de Kirchhoff, en supposant que les capacités thermiques des réactifs ne dépendent pas de la température mais d’une pression constante, :
Pour des conditions standard, la variation de la capacité thermique d’une réaction est définie par l’équation avec les variables v, étant des facteurs stéchiométriques, et , qui représente la chaleur molaire standard d’un réactif donné. Lorsque la différence de température est faible (jusqu’à 100K), la valeur de la chaleur molaire standard du réactif est supposée constante dans une certaine plage. On peut alors utiliser la forme simplifiée de la loi de Kirchhoff, en supposant que les capacités thermiques des réactifs ne dépendent pas de la température mais d’une pression constante, : ![]()
