Dans le cas des réactions chimiques, la conversion complète des substrats en produits n'est observée que pour une petite partie d'entre eux. La grande majorité, y compris celles qui se produisent dans notre corps, sont réversibles. Pour de tels processus, un état d'équilibre chimique est établi. C'est un concept extrêmement important en chimie, qui est associé, par exemple, au principe de Le Chatelier (ou loi d'équilibre). La connaissance des lois et principes de base concernant l'équilibre chimique permet, par exemple, de prédire de nombreuses réactions ou de conduire plus efficacement des processus technologiques.
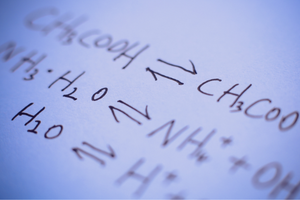
Réactions réversibles et irréversibles
En tenant compte du déroulement des réactions chimiques, une division générale peut être faite – en réactions réversibles et irréversibles. Cependant, il convient de rappeler qu’en réalité, il n’y a pas de réactions irréversibles à 100%et que la qualification à un groupe particulier est basée sur l’effet final dominant.
Réactions irréversibles
Dans ce cas, les substrats du système réagissent et donnent des produits spécifiques. Cependant, il n’y a pas de transformation inverse – les produits en substrats . Dans la formule, une seule flèche est marquée entre les réactifs et la flèche pointe vers les produits. Les réactions irréversibles sont principalement toutes celles dans lesquelles des précipités se forment. En pratique, ils sont insolubles dans l’eau et ne peuvent pas être reconstitués. La réversibilité du processus est également difficile à obtenir dans le cas de réactions se déroulant dans des systèmes ouverts, c’est-à-dire dans un bécher ou une fiole sphérique, d’où l’un des produits résultants, par exemple le dioxyde de carbone, peut s’échapper librement, mais en modifiant les conditions de la réaction, c’est-à-dire en la transférant dans un système fermé, on peut la rendre réversible. Le groupe des réactions irréversibles comprend également tous les processus où l’interaction entre les molécules du produit se produit dans une bien moindre mesure qu’entre les substrats. Ainsi, un tel processus se déroule dans les deux sens, mais du fait que la reconstitution des substrats est négligeable, ils sont en pratique qualifiés de réactions irréversibles.
Réactions réversibles
Ce sont des réactions dans lesquelles des produits se forment à partir de substrats et, en même temps, le processus inverse se produit avec une intensité comparable, c’est-à-dire la reconstitution de substrats à partir de produits. Dans la formule de réaction, deux flèches sont placées entre les réactifs, les flèches pointant dans des directions opposées, pour indiquer la réversibilité des réactions en cours. Les réactions réversibles sont principalement celles qui se déroulent dans des systèmes fermés. Les molécules de substrats et de produits sont incapables de quitter l’environnement de réaction et elles entrent en collision les unes avec les autres, créant des produits et reconstituant des substrats. Un exemple d’une telle réaction est la production d’iodure d’hydrogène à partir d’iode et d’hydrogène.
L’état d’équilibre chimique
Le fait qu’une réaction particulière puisse se produire, ou si elle est réversible ou irréversible, dépend largement des conditions particulières du procédé et du type de procédé. Si une réaction réversible a lieu, c’est-à-dire que les substrats se transforment en produits à la suite d’une réaction chimique et, en même temps, à la suite de collisions de molécules de produits, les substrats subissent une recréation, puis à un moment donné lorsque ces réactions se produisent, un état d’équilibre chimique s’établit . En d’autres termes, les concentrations de substrats et de produits dans le système sont à un niveau constant – leur quantité ne change pas malgré la réaction continue. Dans l’état d’équilibre chimique, les vitesses de réaction dans les deux sens sont les mêmes. L’équilibre chimique, sous certaines conditions, signifie l’état le plus stable pour un système particulier. Le besoin énergétique est alors très faible. La constante d’équilibre chimique, K , est un coefficient qui décrit l’équilibre de deux réactions réversibles. Il est défini comme le quotient des concentrations de produits et de substrats portés aux puissances correspondant aux coefficients stoechiométriques qui ont été mesurés à l’état d’équilibre chimique. La formule de la constante a été dérivée en 1864 sous le nom de loi d’action de masse. Il convient de rappeler qu’il s’agit d’une valeur caractéristique pour une réaction particulière. Un certain nombre de facteurs affectent l’état d’équilibre chimique. Voici quelques-uns d’entre eux :
- Température,
- volume du système réactionnel,
- pression,
- concentration des réactifs.
Ce qui est important, la position de l’état d’équilibre n’est pas affectée par l’ajout ou le changement du catalyseur de réaction. Sa tâche est seulement de raccourcir le temps pendant lequel l’équilibre est atteint. 
Le principe de Le Chatelier (la loi d’équilibre)
En changeant certaines conditions de réaction, on peut influencer son équilibre. Le système s’efforcera toujours de maintenir l’équilibre, car il lui est énergétiquement favorable (dépense énergétique la plus faible). En conséquence, il y aura des changements qui neutraliseront les facteurs qui déséquilibrent le système. Ce phénomène a été expliqué en 1881 et est connu aujourd’hui sous le nom de principe de Le Chatelier-Braun ou de loi d’équilibre. Il permet de comprendre la réponse du système aux changements de conditions d’une réaction, qui se trouve dans un état d’équilibre chimique. L’ajout d’une des substances réactives au système provoque une perturbation de l’équilibre. Les concentrations des réactifs individuels changent. Ainsi, pour contrer cela, le système a tendance à produire plus de produit (lorsqu’un substrat a été ajouté) ou à reconstituer le substrat (lorsqu’une certaine quantité de produit a été ajoutée). La modification de la température de réaction a un impact énorme, en particulier pour les processus endothermiques et exothermiques. Dans le cas du premier, il est nécessaire de fournir de l’énergie au système sous forme de chaleur, donc l’augmentation de la température de l’ensemble du processus déplacera l’équilibre vers la droite (abaissement vers la gauche), vers la formation de plus de produit . L’inverse sera le cas pour les réactions exothermiques, où l’un des produits est la chaleur. La température n’a pas d’effet sur l’équilibre de la réaction, où aucun effet thermique n’est observé. Dans le cas de réactions se déroulant en phase gazeuse, la pression est un aspect très important. L’augmentation de la valeur de ce paramètre, c’est-à-dire la réduction du volume de réaction du système, entraînera un déplacement de l’équilibre de la réaction. La direction des changements dépend des coefficients stoechiométriques dans l’équation de réaction. Ce paramètre n’affectera pas l’équilibre chimique de la réaction dans laquelle la somme des coefficients stoechiométriques des substrats gazeux et des produits est la même. Il convient de rappeler que lorsque le système est éjecté de l’équilibre chimique, la loi d’équilibre s’appliquera et, par conséquent, un nouvel état d’équilibre sera atteint.
